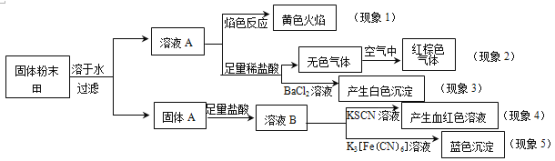
题目内容
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验可用a装置来制备。完成下列填空:
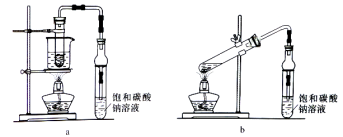
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
【答案】(1)增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。(合理即给分)
浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。
(2)中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解
(3)振荡、静置 (4)原料损失较大、易发生副反应;乙醚;蒸馏
【解析】
试题分析:(1)由于该反应是可逆反应,因此加入过量的乙醇可以增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。由于浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,因此实际用量多于此量;由于增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率,所以在制备乙酸乙酯的实验中浓硫酸的实际用量多于数滴浓硫酸。由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率,所以浓硫酸用量又不能过多。
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解。
(3)乙酸乙酯不溶于水,因此反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液即可。
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应。由于乙醇溶液发生分子间脱水生成乙醚,所以由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,乙醚和乙酸乙酯的沸点相差较大,则分离乙酸乙酯与该杂质的方法是蒸馏。

 阅读快车系列答案
阅读快车系列答案【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
① CO2+ Na2CO3+ H2O === 2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
② 碳酸钠、碳酸氢钠在不同温度下的溶解度
0℃ | 10℃ | 20℃ | 30℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
① 配制碳酸钠溶液:取100 g 20℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
② 利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。

【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
① 取100 g 20℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ② 利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0℃~30℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
① 取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20℃,取上层清液 ② 利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
【题目】如表是元素周期表的一部分,针对表中的①~⑩元素,回答下列问题:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,非金属性最强的元素符号是 ;
(2)⑧元素的氢化物的化学式为 ;
(3)金属性最活泼的元素的原子结构示意图为 ;
(4)能用来雕刻玻璃的氢化物的化学式是 ;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为 (用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式 ;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是 (用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是 (填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.