题目内容
【题目】图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝. 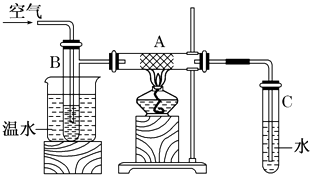
(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是;
(2)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是 , 写出反应的化学方程式 .
【答案】
(1)因为2CH3OH+O2 ![]() 2HCHO+2H2O是一个放热反应,能维持反应所需温度
2HCHO+2H2O是一个放热反应,能维持反应所需温度
(2)有红色沉淀生成;HCHO+4Cu(OH)2 ![]() CO2↑+2Cu2O↓+5H2O
CO2↑+2Cu2O↓+5H2O
【解析】解:(1)醇的氧化反应:2CH3OH+O2 ![]() 2HCHO+2H2O是一个放热反应,能维持反应所需温度,所以不加热的铜丝仍保持红热;故答案为:因为2CH3OH+O2
2HCHO+2H2O是一个放热反应,能维持反应所需温度,所以不加热的铜丝仍保持红热;故答案为:因为2CH3OH+O2 ![]() 2HCHO+2H2O是一个放热反应,能维持反应所需温度;(2)生成的甲醛易溶于水,与新制的氢氧化铜在加热条件下反应生成氧化亚铜红色沉淀,方程式为:HCHO+4Cu(OH)2
2HCHO+2H2O是一个放热反应,能维持反应所需温度;(2)生成的甲醛易溶于水,与新制的氢氧化铜在加热条件下反应生成氧化亚铜红色沉淀,方程式为:HCHO+4Cu(OH)2 ![]() CO2↑+2Cu2O↓+5H2O;故答案为:有红色沉淀生成;HCHO+4Cu(OH)2
CO2↑+2Cu2O↓+5H2O;故答案为:有红色沉淀生成;HCHO+4Cu(OH)2 ![]() CO2↑+2Cu2O↓+5H2O.
CO2↑+2Cu2O↓+5H2O.
(1)根据醇的氧化反应是一个放热反应,能维持反应所需温度;(2)生成的甲醛易溶于水,与新制的氢氧化铜在加热条件下反应生成氧化亚铜红色沉淀.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .
【题目】下表列出了①~⑩十种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
请按要求回答下列问题。
(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是 ____________(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物中,酸性最强的化合物的分子式是:__________,与元素⑥的最高价氧化物对应水化物发生反应时的离子方程式为________________
(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有____________________________。