题目内容
下列叙述不正确的是
| A.原子半径:H<Al<Mg<Na |
| B.热稳定性:HCl<H2S<PH3 |
| C.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| D.N、O、F元素非金属性依次增强 |
B
试题分析:非金属性越强,相应氢化物的稳定性越强,所以B不正确,应该是HCl>H2S>PH3,其余选项都是正确的,答案选B。
点评:元素周期律主要是指化合价、原子半径和金属性以及非金属性等,应该熟练记住。其次还需要注意一些特殊的,例如F没有含氧酸等,该题难度不大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
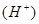 的能力由强到弱的顺序是 (用离子方程式加以说明)。
的能力由强到弱的顺序是 (用离子方程式加以说明)。