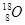题目内容
(12分) A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
(1)第三周期,IIIA族;(2)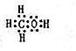
(3)H2O2 H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;
H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;
(4)Cu+ H++H2O2=Cu2++2H2O (5)56L
(6)3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
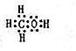
(3)H2O2
 H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;
H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;(4)Cu+ H++H2O2=Cu2++2H2O (5)56L
(6)3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
试题分析:元素推断:A、B、W、D、E为短周期元素,且原子序数依次增大,且A、W能形成两种液态化合物A2W和A2W2知A为H,W为O;进而可知D为Na;E元素的周期序数与主族序数相等,可知为Al;再由五元素质子数之和为39得知B为C元素;
(2)由A、B、W三种元素组成的18电子微粒:即H、C、O,三者电子数分别为1、6、8,加起来为15,只能再加三个氢原子,即18电子微粒应该为CH4O,也就是甲醇。电子式为
 。
。(3)H2O2第一步电离方程式为:H2O2
 H++HO2-,依据强酸制弱酸,可知:BaO2+H2SO4=BaSO4↓+H2O2
H++HO2-,依据强酸制弱酸,可知:BaO2+H2SO4=BaSO4↓+H2O2(4)Cu在酸性环境中与O2反应的离子方程式为:Cu+ H++H2O2=Cu2++2H2O。
(5)由: 2Na +H2 =2NaH; NaH + H2O =" NaOH" + H2↑; 2Al+2NaOH+2H2O =2NaAlO2+3H2↑
知:2Al+2NaH+4H2O =2NaAlO2+5H2↑即可生成2.5molH2,也就是56L。
(6)2Na2O2+2H2O=4Na++4OH— + O2↑ 4Fe2+ +O2 +2H2O=4Fe3++4OH—
两式相加:2Na2O2+4Fe2+ +4H2O=4Na++8OH— + 4Fe3+
上式右边OH—应该全部生成Fe(OH)3↓:Fe3++3OH— = Fe(OH)3↓
2Na2O2+4Fe2+ +4H2O=4Na++8/3Fe(OH)3↓ + 4/3Fe3+
两边再乘3/2即:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
 H和
H和 H
H C D
C D 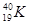 和
和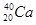
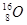 、
、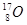 和
和