题目内容
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
C
解析

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol·L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是( )
| A.CuSO4 | B.CuCO3 | C.Cu(OH)2 | D.CuS |
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
| A.滴加新制氯水,溶液pH减小 | B.通入过量SO2气体,溶液pH增大 |
| C.加水,溶液中氢离子浓度增大 | D.加入少量硫酸铜固体,所有离子浓度都减小 |
下列与含氯化合物有关的说法正确的是
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子 |
常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A.弱碱的浓度大于强酸的浓度 |
| B.反应完全后的溶液呈碱性 |
| C.原氨水中有1%的含氮微粒为NH4+ |
| D.反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH;②固体KOH;③固体NaHS;④固体CH3COONa;⑤冰醋酸
| A.只有①② | B.只有③⑤ |
| C.只有②④⑤ | D.只有①⑤ |
常温下,0.1 mol·L-1某一元酸HA溶液中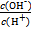 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
| A.c(H+) | B.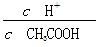 |
| C.c(H+)·c(OH-) | D.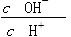 |