题目内容
查阅资料知:2Fe3++M2—===2Fe2++M,向含有M2-、Fe2+的溶液中
缓慢通入氯气,溶液中相关的几种离子的物质的量变化如图所示
(其它离子不参与反应)。
下列说法正确的是
A.B点时溶液中含有Fe3+、Cl—、M2—
B.OD段表示n(Fe3+)的变化情况
C.原溶液中n(Fe2+):n(M2-)=1:4
D.当通入1molCl2后再通入Cl2时,溶液中发生了离子反应是:2Fe2++Cl2==2Fe3++2Cl—

D

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
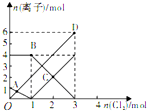 查阅资料知:2Fe3++M2-═2Fe2++M,向含有M2-、Fe2+的溶液中缓慢通入氯气,溶液中相关的几种离子的物质的量变化如图所示(其它离子不参与反应)下列说法正确的是( )
查阅资料知:2Fe3++M2-═2Fe2++M,向含有M2-、Fe2+的溶液中缓慢通入氯气,溶液中相关的几种离子的物质的量变化如图所示(其它离子不参与反应)下列说法正确的是( )| A、B点时溶液中含有Fe3+、Cl-、M2- | B、OD段表示n(Fe3+)的变化情况 | C、原溶液中n(Fe2+):n(M2-)=1:4 | D、当通入1molCl2后再通入Cl2时,溶液中发生了离子反应是:2Fe2++Cl2═2Fe3++2Cl- |

 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.