题目内容
 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
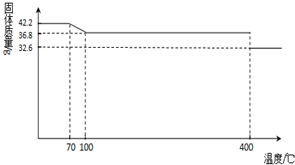
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示.试回答下列问题:
(1)试确定150℃时固体物质的化学式为
K4[Fe(CN)6]
K4[Fe(CN)6]
.(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
.(3)在25℃下,将a mol?L-1的KCN溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
>
>
0.01mol?L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol?L-1
(100a-1)×10-7 mol?L-1
.(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化.已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
.则上述转化的重要意义在于变废为宝,消除污染
变废为宝,消除污染
.(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
.(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了)分析:(1)150℃时K4[Fe(CN)6]?3H2O的结晶水完全失去;
(2)与酸反应放出极毒的氰化氢(HCN)气体,400℃分解;
(3)若是等浓度,反应后生成HCN,溶液显示酸性;再根据电离常数公式求出HCN的电离常数;
(4)催化剂的特点,恢复原来状态,Fe3+→Fe2+;可以降低SO2的污染,同时制得硫酸;
(5)溶液中c(H+)=10-3,c(OH-)=10-11 ,带人Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+)求算.
(2)与酸反应放出极毒的氰化氢(HCN)气体,400℃分解;
(3)若是等浓度,反应后生成HCN,溶液显示酸性;再根据电离常数公式求出HCN的电离常数;
(4)催化剂的特点,恢复原来状态,Fe3+→Fe2+;可以降低SO2的污染,同时制得硫酸;
(5)溶液中c(H+)=10-3,c(OH-)=10-11 ,带人Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+)求算.
解答:解:(1)根据热重曲线,150℃时K4[Fe(CN)6]?3H2O的结晶水完全失去,变成了K4[Fe(CN)6],故答案为:K4[Fe(CN)6];
(2)由于“与酸反应放出极毒的氰化氢(HCN)气体”,再结合根据热重曲线,400℃分解,故应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃,
故答案为:应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃;
(3)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=
(等体积混合,原浓度都减半)c(HCN)=
,带入公式,Ka=10-7?(a-0.01)/0.01=(100a-1)×10-7 mol?L-1,故答案为:>;(100a-1)×10-7 mol?L-1
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+;通过反应,吸收了大气污染物SO2,同时制得了硫酸
故答案为:2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+;变废为宝,消除污染;
(5)、溶液pH为3时,溶液中c(H+)=10-3,则c(OH-)=10-11 ,Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+),c(Fe3+)=1.1×10-36/10-33=1.1×10-3(mol/L)>10-5 mol?L-1,故答案为:c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全.
(2)由于“与酸反应放出极毒的氰化氢(HCN)气体”,再结合根据热重曲线,400℃分解,故应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃,
故答案为:应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃;
(3)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=
| a-0.01 |
| 2 |
| 0.01 |
| 2 |
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+;通过反应,吸收了大气污染物SO2,同时制得了硫酸
故答案为:2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+;变废为宝,消除污染;
(5)、溶液pH为3时,溶液中c(H+)=10-3,则c(OH-)=10-11 ,Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+),c(Fe3+)=1.1×10-36/10-33=1.1×10-3(mol/L)>10-5 mol?L-1,故答案为:c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全.
点评:本题考查难溶物的电离平衡,涉及到了较多的计算,难度较大,需要有一定的化学功底.

练习册系列答案
相关题目



 (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

