题目内容
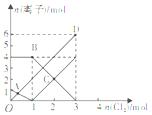
 查阅资料知:2Fe3++M2-═2Fe2++M,向含有M2-、Fe2+的溶液中缓慢通入氯气,溶液中相关的几种离子的物质的量变化如图所示(其它离子不参与反应)下列说法正确的是( )
查阅资料知:2Fe3++M2-═2Fe2++M,向含有M2-、Fe2+的溶液中缓慢通入氯气,溶液中相关的几种离子的物质的量变化如图所示(其它离子不参与反应)下列说法正确的是( )| A、B点时溶液中含有Fe3+、Cl-、M2- | B、OD段表示n(Fe3+)的变化情况 | C、原溶液中n(Fe2+):n(M2-)=1:4 | D、当通入1molCl2后再通入Cl2时,溶液中发生了离子反应是:2Fe2++Cl2═2Fe3++2Cl- |
分析:先根据氧化还原反应方程式判断M2-与Fe2+的还原性强弱,再根据缓慢通入氯气时还原性强的先被氧化,据此判断出曲线A、B、D分别代表的离子;根据通入氯气为0时可以判断原溶液中n(Fe2+):n(M2-);根据曲线D的离子浓度从0开始逐渐增大,可以判断OD段表示n(Cl-)的变化情况;根据图示通入1mol氯气后亚铁离子开始被氧化判断D是否正确.
解答:解:由反应2Fe3++M2-═2Fe2++M可知,离子还原性强弱:M2->Fe2+,所以通入氯气后,先氧化M2-,后氧化Fe2+,根据图示可知A代表M2-,B代表Fe2+,
A、B点时,通入了1mol氯气,恰好将溶液中M2-氧化,铁离子没有被氧化,所以此时溶液中存在Fe3+、Cl-,故A错误;
B、液中缓慢通入氯气,开始时氯离子为0,随着氯气增加,溶液中氯离子浓度物质的量逐渐增大,所以OD段表示n(Cl-)的变化情况,故B错误;
C、根据氯气为0时,纵坐标代表M2-曲线A为1mol,代表Fe2+的曲线B物质的量为4mol,原溶液中n(Fe2+):n(M2-)=4:1,故C错误;
D、当通入1molCl2后M2-被完全氧化成M,再通入Cl2时,亚铁离子开始被氧化,溶液中发生了离子反应是:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
A、B点时,通入了1mol氯气,恰好将溶液中M2-氧化,铁离子没有被氧化,所以此时溶液中存在Fe3+、Cl-,故A错误;
B、液中缓慢通入氯气,开始时氯离子为0,随着氯气增加,溶液中氯离子浓度物质的量逐渐增大,所以OD段表示n(Cl-)的变化情况,故B错误;
C、根据氯气为0时,纵坐标代表M2-曲线A为1mol,代表Fe2+的曲线B物质的量为4mol,原溶液中n(Fe2+):n(M2-)=4:1,故C错误;
D、当通入1molCl2后M2-被完全氧化成M,再通入Cl2时,亚铁离子开始被氧化,溶液中发生了离子反应是:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评:本题考查了铁盐与亚铁盐的转化、氧化还原反应中氧化性与还原性强弱判断,题目难度中等,解题关键是根据氧化还原反应反应判断M2-与Fe2+的还原性强弱,根据强者优先原则分析出图示中各个曲线代表的离子,试题有利于提高学生的分析、理解能力及灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目

 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.