题目内容
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
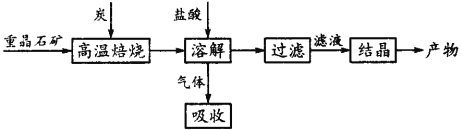
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。
【答案】 过滤 蒸馏 3NaClO3+3H2SO4(浓)= HC1O4+2ClO2↑+3NaHSO4+H2O 4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O 2ClO2+2OH-+H2O=2ClO2-+O2+2H2O 639kg 4H2O+HCl-8e-=HClO4+8H+
【解析】本题考查化学工艺流程,涉及实验基本操作、化学反应方程式的书写、化学计算等知识,(1)根据流程,操作①得到晶体和滤液,因此操作①为过滤;操作②从溶液中得到高氯酸,根据信息,高氯酸是液体,沸点在130℃,因此操作②是蒸馏;(2)反应器I中加入NaClO3和浓硫酸,得到ClO2、NaHSO4、HClO4,大概形式为NaClO3+H2SO4→ClO2↑+NaHSO4+HClO4,根据化合价的升降法进行配平,得出:3NaClO3+3H2SO4→2ClO2↑+3NaHSO4+HClO4,产物中缺少2个氢原子和1个氧原子,即少了1个H2O,化学反应方程式为3NaClO3+3H2SO4(浓)= HC1O4+2ClO2↑+3NaHSO4+H2O ;(3)根据流程,ClO2中Cl显+4价,转变成NaClO2,其中Cl显+3价,显然SO2作还原剂,SO2用H2O2代替,H2O2作还原剂,被氧化成氧气,根据化合价的升降、原子守恒、所带电荷守恒进行配平,离子反应方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O;(5)根据(2)中反应方程式,3NaClO3~HClO4,因此m(NaClO3)=201×3×106.5/100.5kg=639kg;(6)根据电解原理,阳极上发生氧化反应,化合价升高,阳极反应式为4H2O+HCl-8e-=HClO4+8H+。

 学业测评一课一测系列答案
学业测评一课一测系列答案