题目内容
【题目】把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是

A. ①④ B. ③④ C. ①②③ D. ②③
【答案】C
【解析】
试题分析:镁条投入到盛有盐酸的敞口容器里发生的反应是:2H++Mg=Mg2++H2, ①开始盐酸的浓度较大,反应速率快,但随反应的进行,浓度减小,则反应速率减小;②由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小;③反应开始H+离子浓度最大,随着反应进行浓度会逐渐减小,但反应速率逐渐增大,因该反应为放热反应,放热使温度升高,则反应速率加快;④因Cl-不参加反应,Cl-的浓度增大或减小都不影响化学反应速率,且该反应中Cl-的浓度不变;所以影响反应速率的因素是①②③,C项正确;答案选C。

【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
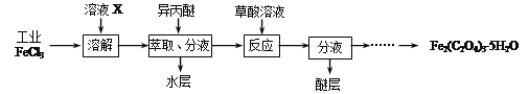
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。