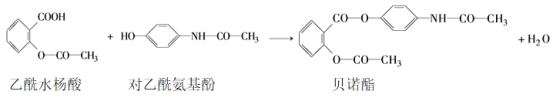
��Ŀ����
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X(g)+Y(g) ![]() 2Z(g)��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵������ȷ����
2Z(g)��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵������ȷ����
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ��Ӧǰ2min��ƽ������v��Z��=2.0��10-3 mol��L-1��min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��v����)��v������
C. ���¶��´˷�Ӧ��ƽ�ⳣ����K=1.44
D. ���������������䣬��ʼʱ����������0.32 mol����X��0.32 mol����Y������ƽ��ʱ��c��Z��=0.024 mol/L
���𰸡�A
��������
A��2min��Y���ʵ����仯Ϊ0.16mol-0.12mol=0.04mol���������ʹ�ʽ����v��Y��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��Z����
B���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v��������
C����Ӧ7 minʱ����Ӧ�ﵽƽ�⣬������ʼ����ƽ��ʱY������������ʽ������ƽ��Ũ�ȼ��㷴Ӧ��ƽ�ⳣ����
D�����������������䣬��ʼʱ�������г���0.32mol����X��0.32mol����Y���൱�ڵ�ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ���
A�2min��Y���ʵ����仯Ϊ0.16mol-0.12mol=0.04mol��YŨ�ȱ仯Ϊ0.04mol/10L= 0.004mol/L����v��Y��=![]() =0.002mol/��Lmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Z��=2v��Y��=2��0.002mol/��Lmin��=0.004mol/��Lmin������A����
=0.002mol/��Lmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Z��=2v��Y��=2��0.002mol/��Lmin��=0.004mol/��Lmin������A����
B��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v����������B��ȷ��
C�����X������Y����ʼŨ�Ⱦ�Ϊ0.16mol/10L=0.016 mol/L����Ӧ7 minʱ��Ӧ�ﵽƽ�⣬ƽ��ʱY��Ũ��Ϊ0.010 mol/L����Y�ı仯Ũ��Ϊ0.006 mol/L����ƽ��ʱ��X��Ũ��Ϊ0.010 mol/L��Z��Ũ��Ϊ0.012 mol/L����Ӧ��ƽ�ⳣ��Ϊ��0.012 mol/L��2/0.010 mol/L��0.010 mol/L=1.44��C��ȷ��
D�X��g��+Y��g���T2Z��g����ͼ�����ݷ���ƽ�������YΪ0.16mol-0.1mol=0.06mol������ZΪ0.12mol�����������������䣬��ʼʱ�������г���0.32mol����X��0.32mol����Y���൱�ڵ�ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ�������ƽ��ʱ��n��Z��=0.24mol����D��ȷ��
��ѡA��

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�����Ŀ��±�ؼ��仯��������������������й㷺Ӧ�á�
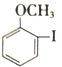
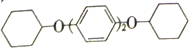
��1���Ӻ����ȸ��������������ȡ��Ĺ��ղ���֮һΪ:��ϡ�����ữ������.�ö�����������I-�������ӷ���ʽΪ____���÷�Ӧ�Ļ�ԭ����Ϊ______(�ѧʽ).
��2���Ӻ�ˮ����ȡ��Ĺ�����:���ữ�ĺ�ˮ��ͨ������![]() ������
������![]() ������
������![]() �ᴿ�塣
�ᴿ�塣
��֪������Ϣ(����a>0,b>0)��
��.H2(g)+Cl2(g)=2HCl(g)��H=-akJ/mol
��.H2(g)+Br2(g)=2HBr(g)��H2=-bkJ/mol
��.���ֻ�ѧ���ļ������������ʾ:
��ѧ�� | H-Br | H-Cl | Cl-Cl | Br-Br |
����/(KJ/mol) | 366 | 432 | 243 | 194 |
���ữ��ˮ��Ŀ����_______
�ڱȽϴ�С��a_____b(����>������=������<��)
�ۼ���2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)��H=_____kJ/mol(�������ֵ)=_____kJ/mol (�a,b�Ĵ���ʽ)
��3��298K,ȡһ�����ĺ�Br-��Cl-��Ũ����Һ���μ�ϡ��������Һ��������dz��ɫ����ʱ����ƽ��: AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ_______��֪��[Ksp(AgCl)=1.54��10-10��Ksp(AgBr)=7.7��10-13]��
AgBr(s)+Cl-(aq)���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ_______��֪��[Ksp(AgCl)=1.54��10-10��Ksp(AgBr)=7.7��10-13]��
��4��������Fe3+��I-��ˮ�еķ�ӦΪ2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)(����������ˮ��)�����������˵���÷�Ӧ�ﵽƽ��״̬����_____(����ĸ)
2Fe2+(aq)+I2(aq)(����������ˮ��)�����������˵���÷�Ӧ�ﵽƽ��״̬����_____(����ĸ)
A.Fe3+�����������ʵ���Fe2+����������
B.��Һ����ɫ���ֲ��ٱ仯
C.2v(I-)��=v(I2)��
D.��Һ�е�c(Fe3+)=c(I-)
E.��Һ�е�![]() ���ֲ��ٱ仯
���ֲ��ٱ仯
��5��CuBr2��һ����Ҫ�Ļ���ԭ�ϣ����ܱ�������Ͷ��������CuBr(s),��һ���¶��·�����Ӧ��2CuBr2(s)![]() 2CuBr(s)+Br2(g)��Ӧ�ﵽƽ��ʱ��c(Br2)=10mol/L������¶ȱ��ֲ��䣬���������������ԭ����һ����ƽ��ʱc(Br2)��Ũ��(mol/L)����Ϊ____mol/L (����ĸ)��
2CuBr(s)+Br2(g)��Ӧ�ﵽƽ��ʱ��c(Br2)=10mol/L������¶ȱ��ֲ��䣬���������������ԭ����һ����ƽ��ʱc(Br2)��Ũ��(mol/L)����Ϊ____mol/L (����ĸ)��
A.0.5 b.1.0 c.3.0 d.4.0
����Ŀ����һ���¶��£�10mL0.40mol/L H2O2�������ֽ⡣��ͬʱ�̲ⶨ����O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v��H2O2��![]()
![]() mol/(L��min)
mol/(L��min)
B��6~10min��ƽ����Ӧ���ʣ�v��H2O2����![]() mol/(L��min)
mol/(L��min)
C����Ӧ��6minʱ��c��H2O2��=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%