��Ŀ����
����Ŀ����ʯ���ѽ�õ���2����ϩ����һ������Ϊԭ��ͨ��ͼʾ�ϳɸ߷��ӻ�����I��
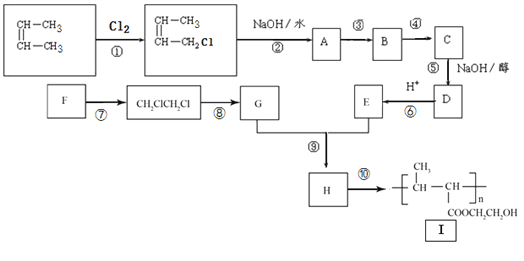
��֪����Ӧ�ۢ�����һ����Ӧ����HCl�ӳɵķ�Ӧ
�ش��������⣺
��1����Ӧ�ٵķ�Ӧ����___________��������ȥ��Ӧ����________(�����)
��2��B�Ľṹ��ʽ__________________________��E�еĹ����ŵ�����Ϊ_________
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��ע����Ӧ����
��Ӧ��____________________________________________________��
��Ӧ��____________________________________________________
��4��E��ͬϵ���ͨʽΪ_________;E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ����___________�֣������������칹����д�����д�֧����ͬ���칹��Ľṹ��ʽ_______________��
���𰸡� ���� ��  ̼̼˫�� �Ȼ�
̼̼˫�� �Ȼ� 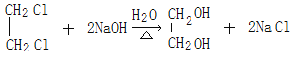 ȡ����Ӧ����ˮ�ⷴӦ��
ȡ����Ӧ����ˮ�ⷴӦ�� ![]()
ȡ����Ӧ��������Ӧ�� CnH2n-2O2 5 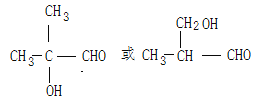
����������1����Ӧ���Ǽ�����ԭ�ӱ���ԭ��ȡ������Ҫ�ڹ��������½��С���Ӧ����±������ˮ�ⷴӦ����A�Ľṹ��ʽΪCH3CH=CHCH2OH������I�Ľṹ��ʽ��֪H�����Ӿ۷�Ӧ����I����H�Ľṹ��ʽΪCH3CH=CHCOOCH2CH2OH��E��G����������Ӧ����H������G��HOCH2CH2OH����F����ϩ��E��CH3CH=CHCOOH��D�ữ����E����D�Ľṹ��ʽΪCH3CH=CHCOONa��C���������ƵĴ���Һ�з�����ȥ��Ӧ����D������Ϊ��Ӧ�ۢ�����һ����Ӧ����HCl�ӳɵķ�Ӧ����̼̼˫�����ǻ����ܱ��������������ȷ����ӳɷ�Ӧ��Ȼ���������ǻ�������Ӧ���Ǽӳɷ�Ӧ��B�Ľṹ��ʽΪCH3CH2CHClCH2OH��CH3CHClCH2CH2OH����Ӧ����������Ӧ��C�Ľṹ��ʽΪCH3CH2CHClCOOH��CH3CHClCH2COOH���������Ϸ�����֪������ȥ��Ӧ���Ǣݣ���2��B�Ľṹ��ʽΪCH3CH2CHClCH2OH��CH3CHClCH2CH2OH��E��CH3CH=CHCOOH��E�еĹ����ŵ�����Ϊ̼̼˫�����Ȼ�����3����Ӧ����±������ˮ�ⷴӦ������ʽΪ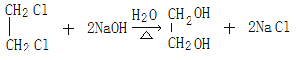 ����Ӧ����������Ӧ������ʽΪ
����Ӧ����������Ӧ������ʽΪ![]() ����4��E��CH3CH=CHCOOH�������к���1��̼̼˫�������E��ͬϵ���ͨʽΪCnH2n-2O2��E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ��HOCH2CH2CH2CHO��CH3CHOHCH2CHO��CH3CH2CHOHCHO��(CH3)2COHCHO��HOCH2CH(CH3)CHO���ϼ���5�������д�֧����ͬ���칹��Ľṹ��ʽΪ(CH3)2COHCHO��HOCH2CH(CH3)CHO��
����4��E��CH3CH=CHCOOH�������к���1��̼̼˫�������E��ͬϵ���ͨʽΪCnH2n-2O2��E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ��HOCH2CH2CH2CHO��CH3CHOHCH2CHO��CH3CH2CHOHCHO��(CH3)2COHCHO��HOCH2CH(CH3)CHO���ϼ���5�������д�֧����ͬ���칹��Ľṹ��ʽΪ(CH3)2COHCHO��HOCH2CH(CH3)CHO��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��̼�������仯����������������ء������Ҫ��ش���������:
(1)��CH4����ԭ��������������������������Ⱦ����֪:
��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H= ��574kJ/mol
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H= ��1160kJ/mol
��H2O(g)=H2O(l) ��H= ��44kJ/mol
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(1)���Ȼ�ѧ����ʽ_________��
(2)��֪:��ӦI:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0
��ӦII:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H<0
2N2(g)+6H2O(g) ��H<0
���ں��º���װ���г���һ������NH3��O2,�ڴ����������½��з�ӦI���������й���������ȷ����___(����ĸ���)��
A.����ѹǿ��Kp(��ѹǿ��ʾ�Ļ�ѧƽ�ⳣ��)����
B.�����������3v(NH3)=2v (H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.ͨ��һ�����ĵ�������ѧ��Ӧ��������
D.�ﵽƽ��ʱ��ϵ��ѹǿ���ٱ仯
�ڰ�������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1molNH3��2molO2�����й����ʵ�����ϵ��ͼ���ô����ڵ���ʱѡ��Ӧ_____(�I����II��)��
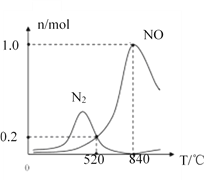
��520��ʱ��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ�����軯��)����ѹ�����У�Ϊ�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______(����ĸ���)
2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ�����軯��)����ѹ�����У�Ϊ�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______(����ĸ���)
A.���ͷ�Ӧ�¶� B. Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
C.����NH3��O2�ij�ʼͶ�ϱ� D. ����һ�����ĺ���
��3����֪25��ʱHCN��H2CO3�ĵ��볣��(Ka.)���±�:
���� | ���볣��(Ka) |
HCN | Ka=5��10-10 |
H2CO3 | Ka1=4.5��10-7��Ka2=4.7��10-11 |
25��ʱ����õ������Ũ�ȵ�HCN��NaCN�Ļ����ҺpH=11,��c(Na+)��c(H+)��c(CN��)��c(OH��)��c(HCN)Ũ���ɴ�С˳��Ϊ______����NaCN��Һ��ͨ������CO2��������Ӧ�Ļ�ѧ����ʽΪ:______________________��