题目内容
下列实验设计及其对应的离子方程式均正确的是
| A.Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O—+SO2+H2O=HC1O↓+2HC1O |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32 |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO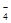 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
B
解析试题分析:A.HC1O有强的氧化性,能将亚硫酸钙氧化为硫酸钙,错误。B.澄清石灰水与小苏打溶液混合时随二者的相对多少不同,反应不同。若是澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O;若是澄清石灰水与足量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+H2O+CO32-,正确。C.二氧化碳过量,应该生成碳酸氢钠,错误。D盐酸、过氧化氢都有还原性,都会与高锰酸钾发生反应,所以酸化的KMnO4溶液要用硫酸来酸化。错误。
考点:考查物质的相对多少对化学反应的影响及影响溶液氧化性、还原性的因素等相关知识。

练习册系列答案
相关题目
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是( )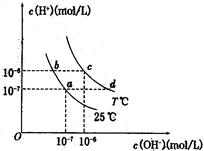
| A.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
B.b点对应的溶液中大量存在: 、K+、Cl-、 、K+、Cl-、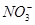 |
| C.d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
D.a点对应的溶液中大量存在: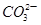 、Na+、Cl-、 、Na+、Cl-、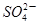 |
下列反应的离子方程式中,正确的是( )
| A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ |
| B.稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-= H2O +BaSO4↓ |
| C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 |
| D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O |
下列物质中属于非电解质的是( )。
| A.NaOH | B.O2 | C.Na2CO3 | D.乙醇 |
对于电解质的导电能力,下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.导电能力强的溶液一定是浓溶液 |
| C.相同温度下,导电能力强的溶液中离子个数一定多 |
| D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强 |
下列各组离子在指定溶液中能大量共存的是
| A.无色溶液中:K+、Na+、MnO4-、SO42- |
| B.含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
| C.加入Al能产生H2的溶液中:I-、NO3-、SO42-、NH4+ |
| D.在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
下列各组离子中可能大量共存的是
| A.在能使紫色石蕊试剂变红的溶液中:Na+、SO42-、Cl-、HCO3- |
| B.在强酸性溶液中:NH4+、Ba2+、Fe2+、Br-、NO3- |
| C.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、Al3+ |
| D.在水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。
下列有关离子反应或离子方程式的叙述中,正确的是 ( )
| A.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O= 2HClO+CO32- |
| D.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
下列离子方程式正确的是( )
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.向苯酚溶液中滴加Na2CO3溶液: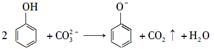 |
| D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-=3Fe3++NO↑+2H2O |