题目内容
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是( )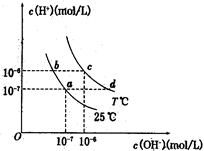
| A.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
B.b点对应的溶液中大量存在: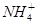 、K+、Cl-、 、K+、Cl-、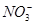 |
| C.d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
D.a点对应的溶液中大量存在: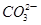 、Na+、Cl-、 、Na+、Cl-、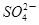 |
B
解析试题分析:A选项c点溶液中显中性,Fe2+不能存在,错误。B选项b点显酸性,这些离子可以大量共存,正确。C选项d点显碱性,Al3+不能共存,错误。D选项a点显中性,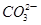 水解显碱性,不能满足题意,错误。
水解显碱性,不能满足题意,错误。
考点:在不同酸碱性条件下的离子大量共存问题。

练习册系列答案
相关题目
在由水电离出的c(H+)=10-13mol·L-1的溶液中一定能够大量存在的离子组是
| A.Ba2+、Na+、Cl-、NO3- | B.Al3+、Ca2+、SO42-、Br- |
| C.NH4+、K+、HSO3-、CO32- | D.Na+、K+、Cl-、I- |
下列离子组在强酸性溶液中能大量共存、且溶液为无色透明的是
| A.NH4+、Al3+、SO42-、NO3- | B.Ag+、Na+、[Al(OH)4]-、Cl- |
| C.K+、NH4+、MnO4-、SO42- | D.K+、Na+、SO42-、HCO3- |
有关粒子在相应条件下能大量共存的是
| A.常温常压下混合气体:H2、F2、NO、O2 |
| B.能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C.c(H+)="1.0" mol·L-1的溶液中:K+、Fe3+、SO42-、I- |
| D.澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |
如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是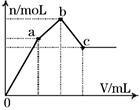
| A.NH4Al(SO4)2 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.Na2SO4与NaAlO2组成的混合物 |
下列物质属于电解质的是
| A.Cu | B.硝酸钾溶液 | C.AgCl | D.NH3 |
下列离子方程式,正确的是
| A.氢氧化铁与盐酸反应:H++OH-=H2O |
| B.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O |
| C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO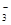 +Ca2++OH-= CaCO3↓+H2O +Ca2++OH-= CaCO3↓+H2O |
下列实验设计及其对应的离子方程式均正确的是
| A.Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O—+SO2+H2O=HC1O↓+2HC1O |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32 |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
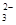 、NO3-、Na+、S2-、AlO2-、SO32-;
、NO3-、Na+、S2-、AlO2-、SO32-;