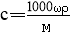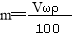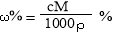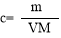题目内容
已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
(1)略(2分) (2)锰 (2分) 10NA (2分) (3)44.8L (2分)
(4)0.05mol(2分)0.95(2分)
【解析】
试题分析:(2)氧化还原反应中,氧化剂,得到电子,化合价降低,被还原,发生还原反应,对应的是还原产物,因此可以分析出被还原的是锰元素。当有5mol的氯气生成时,转移的电子总数为10mol,换成微粒数就是: 10NA 。
(3)从方程式上可以看出,反应16mol的盐酸,其中被氧化的只有10mol,转移十摩尔的电子,生成5mol的氯气,因此,若有4 molHCl被氧化,则可生成标准状况下的氯气为2mol ,体保为44.8L 。
(4)1.58g高锰酸钾为0.01mol ,反应中可以看出,每反应2mol的KMnO4,则有10mol的盐酸被氧化,因此,当有0.01mol 的高锰酸钾反应时,被氧化的盐酸的物质的量就为:0.05mol。
2KMnO4+10HCl(浓)+6HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
0.01mol 0.05mol
那么溶液中剩余的氯离子的物质的量为:100mL×10moL/L-0.05mol=0.95mol
将反应后的溶液取出10mL,其中的氯离子的物质的量为0.095mol。加入足量的硝酸银溶液,可得到沉淀的物质的量为0.095mol。
考点:氧化还原的有关知识。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
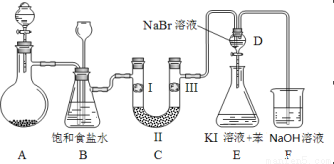
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为 ;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 ;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 ;
| a | b | c | d |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明 ;
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 ;
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式 ;