题目内容
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
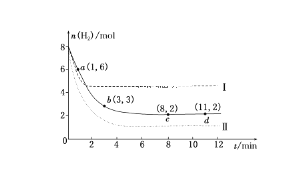
(1)a点正反应速率________(填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是________。
A.0~1 min B.1~3 min
C.3~8 min D.8~11 min
(3)平衡时CO2的转化率为________,该条件下的平衡常数K=________。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是________,曲线Ⅱ对应的实验条件改变是________。
【答案】(1)> (2)A (3)33.3﹪ K=0.5 (4)升高温度 增大压强。
【解析】
试题分析:(1)反应是从正反应方向开始的。由于在a点时反应还没有达到化学平衡,所以反应速率V(正)>V(逆) (2)反应是在体积固定的密闭容器中进行的,在反应的过程中物质的浓度越大,反应速率越快。由于在开始时反应物的浓度最大,所以在开始不久反应的速率最快。选项为A。(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)="4mol/L." C(CH3OH)="0mol/L," C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K="{" C(CH3OH)·C(H2O)} ÷{ C(CO2) ·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。
CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)="4mol/L." C(CH3OH)="0mol/L," C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K="{" C(CH3OH)·C(H2O)} ÷{ C(CO2) ·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案