题目内容
(2011?门头沟区模拟)下列反应的离子方程式正确的是( )
分析:A.碳酸根离子水解的实质是碳酸根离子与水反应;
B.向100mL0.1mol/L的FeBr2溶液中缓慢通入标准状况下的224mLCl2:等物质的量反应,亚铁离子全部被氧化,溴离子一半被氧化;
C.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7,二者的物质的量之比为1:2;
D.根据沉淀的转化来分析.
B.向100mL0.1mol/L的FeBr2溶液中缓慢通入标准状况下的224mLCl2:等物质的量反应,亚铁离子全部被氧化,溴离子一半被氧化;
C.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7,二者的物质的量之比为1:2;
D.根据沉淀的转化来分析.
解答:解:A.碳酸钠的水解反应的离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.向100mL0.1mol/L的FeBr2溶液中缓慢通入标准状况下的224mLCl2:等物质的量反应,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B正确;
C.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.向氯化银悬浊液中加入饱和碘化钾溶液的离子反应为AgCl+I-?AgI+Cl-,故D错误;
故选B.
B.向100mL0.1mol/L的FeBr2溶液中缓慢通入标准状况下的224mLCl2:等物质的量反应,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B正确;
C.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.向氯化银悬浊液中加入饱和碘化钾溶液的离子反应为AgCl+I-?AgI+Cl-,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,B为学生解答中的易错点和难点.

练习册系列答案
相关题目
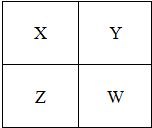 (2011?门头沟区模拟)已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
(2011?门头沟区模拟)已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )