题目内容
(2011?门头沟区模拟)下列叙述中的前后两个量之比为1:2的是( )
分析:A.碱式滴定管下端没有刻度的地方有溶液;
B.弱酸的浓度越小,电离程度越大;
C.根据电荷守恒及pH=7时c(H+)=c(OH-)来分析;
D.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L.
B.弱酸的浓度越小,电离程度越大;
C.根据电荷守恒及pH=7时c(H+)=c(OH-)来分析;
D.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L.
解答:解:A.碱式滴定管下端没有刻度的地方有溶液,则液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积不是1:2,故A错误;
B.弱酸的浓度越小,电离程度越大,则相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比大于1:2,故B错误;
C.pH=7时c(H+)=c(OH-),由电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(SO42-),则c(NH4+)=c(SO42-),故C错误;
D.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L,c〔(Ba(OH)2〕=0.005mol/L,c(KOH)=0.01mol/L,所以c〔(Ba(OH)2〕:c(KOH)=1:2,故D正确;
故选D.
B.弱酸的浓度越小,电离程度越大,则相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比大于1:2,故B错误;
C.pH=7时c(H+)=c(OH-),由电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(SO42-),则c(NH4+)=c(SO42-),故C错误;
D.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L,c〔(Ba(OH)2〕=0.005mol/L,c(KOH)=0.01mol/L,所以c〔(Ba(OH)2〕:c(KOH)=1:2,故D正确;
故选D.
点评:本题考查离子浓度的关系,熟悉仪器的结构、电离与浓度的关系、电荷守恒、pH与浓度的关系即可解答,题目难度不大,A为易错点.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
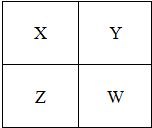 (2011?门头沟区模拟)已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
(2011?门头沟区模拟)已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )