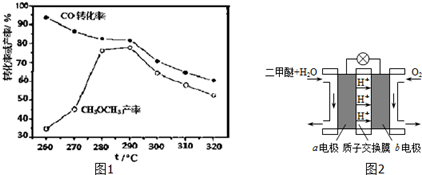
题目内容
在Na2SO4和Al2(SO4)3的混合液中,Al3+和SO42-的物质的量浓度分别为0.2mol/L、0.4mol/L,混合液中Na+的物质的量浓度为( )mol/L.
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:由电荷守恒可知,溶液中阳离子的电荷总数等于阴离子的电荷总数,可得:3c(Al3+)+c(Na+)=2c(SO42-),据此解答.
解答:
解:根据电荷守恒得:3c(Al3+)+c(Na+)=2c(SO42-),
故c(Na+)=2c(SO42-)-3c(Al3+)=2×0.4mol/L-3×0.2mol/L=0.2mol/L,
故选C.
故c(Na+)=2c(SO42-)-3c(Al3+)=2×0.4mol/L-3×0.2mol/L=0.2mol/L,
故选C.
点评:本题考查物质的量浓度的计算,明确电荷守恒为解答的关键,侧重分析能力和计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列关于乙醇的说法正确的是( )
| A、常温下是一种无色无味的液体 |
| B、能和乙酸发生加成反应 |
| C、能和Na2CO3溶液反应 |
| D、可发生氧化反应 |
 大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )
大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )| A、△H=E2-E3 |
| B、E1-E3=△H1+△H2 |
| C、氯原子可使E1减少 |
| D、2O2═O3+O是吸热反应 |
下列对有机物结构或性质的描述中错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种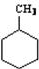 |
下列叙述正确的是( )
| A、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液一定可以大量存在K+、Na+、AlO2-、SO42- | ||
B、常温时,0.1mol/L HA溶液的PH>1,0.1mol/LBOH溶液中
| ||
| C、用0.10mol?L-1 NaOH溶液滴定某浓度的醋酸溶液时,指示剂选酚酞比选用甲基橙误差小 | ||
| D、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均减小 |
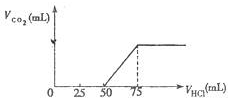 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、产生的CO2体积(标准状况下)为0.056L |
| B、原NaOH溶液的物质的量浓度为0.5mol?L-1 |
| C、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- |
| D、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
下列说法正确的是( )
| A、在含2mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA |
| B、30g二氧化硅晶体中含有0.5NA个二氧化硅分子 |
| C、金刚石晶体中,碳原子数与C-C键数之比为1:2 |
| D、晶体硅、晶体氖均是由相应原子直接构成的原子晶体 |
下列离子或分子组中能大量共存,且满足相应要求的是( )
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |