��Ŀ����
(16��)
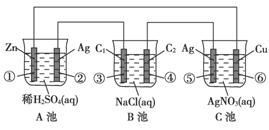
(1)���ʱ���Ƽ����Դ�� �����ӡ�
(2)��ѧ�Ƶ�ԭ�������û�ѧ��Ӧ���ɽ������ʳ����ڶƼ������γɶƲ㡣
�� ����ͭ�ν��л�ѧ��ͭ��Ӧѡ�ãߣ������������ԭ��������֮��Ӧ��
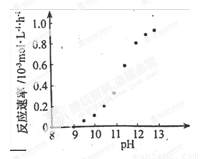
�� ij��ѧ��ͭ�ķ�Ӧ�������ҺpH �仯����ͼ��ʾ���ö�ͭ�����У���ҺpH ������12.5���ҡ���ͼ����Ϣ������ʹ��Ӧֹͣ�ķ�����
(3)�������ȡ����ͭ������ʾ��ͼ����
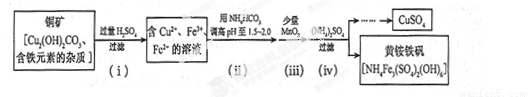
�� ���裨i����Cu2(OH) 2CO3 ������Ӧ�Ļ�ѧ����ʽΪ ��
�� ���裨ii�������Լ������pH ���õ������� �������ӷ��ţ���
�� �ڲ��裨iii�������ķ�Ӧ�У�1 mol MnO2ת��2 mol ���ӣ��÷�Ӧ�����ӷ���ʽΪ ��
�� ���裨iv����ȥ���ʵĻ�ѧ����ʽ�ɱ�ʾΪ
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6��6H +
���˺�ĸҺ��pH = 2.0 , c (Fe3+) =a mol��L-1��, c ( NH4+��=b mol��L-1��, c ( SO42-��= d mol��L-1���÷�Ӧ��ƽ�ⳣ��K=�� ���ú�a ��b ��d �Ĵ���ʽ��ʾ����
(1) ��
(2) �ٻ�ԭ�� �ڵ�����ҺpH��8��9֮��
(3)�� Cu2(OH)2CO3��2H2SO4��2CuSO4+CO2��+3H2O��
�� HCO3�� ��
�� MnO2+2Fe2��+4H�� Mn2��+2Fe3��+2H2O��
Mn2��+2Fe3��+2H2O��
��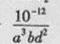
��������(1)���ʱ�����Ƽ����Դ�ĸ�����������Һ�еĶƲ�������ӵõ������ڶƼ���������
(2) �٢ڻ�ѧ��Ƶ�ԭ�����������û���Ӧ���Ʋ�������Ӵ���Һ���û���������ͭ�����û���ͭͨ����Fe�Ȼ�ԭ��������ͼ�ɿ�����ҺpH����9ʱ���û�ѧ�Ƶķ�Ӧ����Ϊ0����˿ɵ���pH��С��9����ʹ��Ӧֹͣ��
(3)��Cu2(OH)2CO3����H2SO4�ķ�ӦΪ��Cu2(OH)2CO3��2H2SO4��2CuSO4+CO2��+3H2O��
�ڼ����NH4HCO3�е�NH4�� ˮ�������ԣ�HCO3�� ˮ���Լ��ԣ��ҿ�������Һ�е�H����Ӧ���������pH���õ�������HCO3�� ��
����Һ�о��л�ԭ�Ե�ֻ��Fe2�����ٸ���1molMnO2ת��2mol���ӣ�����д����Ӧ�����ӷ���ʽΪMnO2+2Fe2��+4H�� Mn2��+2Fe3��+2H2O��
Mn2��+2Fe3��+2H2O��
�ܻ�ѧƽ�ⳣ�����Ǵﵽ��ѧƽ��ʱ��������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��ע����Һ�еij�����ˮ��Ũ�ȿ�����1��
���㶨λ�����⿼���˵��ԭ������ѧƽ���Ӧ�ú����ʵ��Ʊ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�(16��) ��֪ X��Y��Z��Q��R��E����Ԫ���У�ԭ������X��Y��Z��Q��R��E����ṹ��������Ϣ���±���
|
Ԫ�� |
�ṹ��������Ϣ |
|
X |
ԭ�ӵ�L����s����������p�������� |
|
Y |
ԭ�Ӻ����L����3��δ�ɶԵ��ӡ� |
|
Z |
��Ԫ�����ڱ��ĸ�Ԫ���е縺�Խ�С�ڷ��� |
|
Q |
���ʳ��¡���ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���ӡ� |
|
R |
�˵������Y��Q�ĺ˵����֮�� |
|
E |
ԭ��������R��3 |
�������Ϣ�ش��й����⣺
��1��Ԫ��Y��ԭ�Ӻ���� �ֲ�ͬ�˶�״̬�ĵ��ӣ��� �ֲ�ͬ�ܼ��ĵ��ӡ�
(2) X��Y��Z����Ԫ�صĵ�һ�������ɸߵ��͵����д�������Ϊ��дԪ�ط��ţ� ��
��3��X��Z��QԪ�ؾ�������ͻ��ϼ�ʱ�������⻯���У��е��ɸߵ��͵����д�������Ϊ��д��ѧʽ�� ��
(4)R�ĺ�������Ų�ʽΪ ��R��һ�������Ļ�ѧʽΪRCl3��6H2O����֪0.01 molRCl3��6H2O��ˮ��Һ���ù�����������Һ����������0.02 mol AgCl�������������������� ��
A��[R(H2O)6]Cl3 B��[R(H2O)5Cl]Cl2��H2O
C��[R(H2O)4Cl2]Cl��2H2O D��[R(H2O)3Cl3]��3H2O
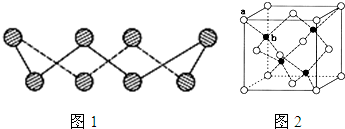
��5��Ԫ��E���γɰ����幹�͵����������[E (YH3) x Q 2]+��������ԭ��Ϊ��д��ѧʽ�� ����λ��Ϊ��д��ѧʽ�� ��x ��ֵΪ ��
(6) Y����ͼ��⻯����Z��һ���⻯�ﷴӦ�����ɵ����ֲ��������Ⱦ�������䷴Ӧ�Ļ�ѧ����ʽΪ ��