题目内容
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.0.1mol/LNaHSO4溶液中: K+ NH4+ HCO3— NO3— |
| B.与铝反应产生氢气的溶液中:Na+ NH4+ SO42—、 CH3COO— |
| C.滴加酚酞显红色的溶液中: Na+ NO3— SO42— CO32— |
| D.NaNO3溶液中: Fe2+ H+ Cl— I— |
C
试题分析:A.NaHSO4是强电解质。电离方程式是:NaHSO4=Na++H++SO42-。所以它的水溶液显酸性。在酸性溶液中HCO3—和H+不能大量共存。错误。B铝在酸性或碱性溶液中都会发生反应产生氢气。在酸性溶液中CH3COO—和H+不能大量共存;在碱性溶液中NH4+和OH-不能大量共存。错误。C.滴加酚酞显红色的溶液中是碱性溶液。OH-和Na+ NO3— SO42— CO32—不发生反应,可以共存。正确。D.NO3-和Fe2+ H+会发生氧化还原反应而不能大量共存。错误。

练习册系列答案
相关题目
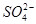 、
、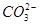 、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中