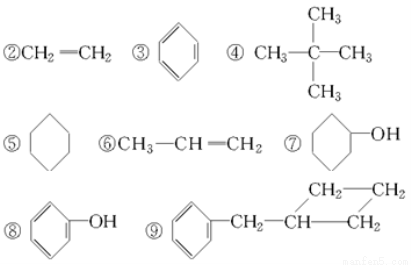
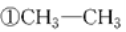题目内容
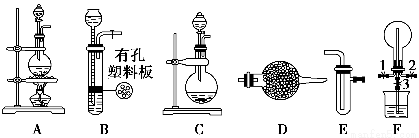
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。

(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
(1)FeCl3溶液 除去H2S、PH3等杂质气体
(2)部分乙炔会从长颈漏斗逸出,造成实验误差,且不易控制加水量
(3)反应产生的泡沫易堵塞导管 在装置的导管口加上一团棉花
(4) 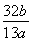 ×100%
×100%
【解析】A瓶中的液体是用来除去混在乙炔中的H2S、PH3,酸性KMnO4溶液会在除去H2S、PH3的同时也将C2H2氧化,故选用FeCl3溶液,装置Ⅰ和Ⅱ均可制乙炔,但装置Ⅰ的主要缺点为部分乙炔气体会从长颈漏斗口逸出,造成实验误差,且长颈漏斗也不易控制加水量。由于CaC2与水剧烈反应产生泡沫,故装置Ⅱ的缺点为泡沫易堵塞导管,可在装置的导管口加上一团棉花。实验时,B处溴水增加质量即为所吸收乙炔的质量,由题意则有:n(CaC2)=n(C2H2)=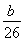 mol,m(CaC2)=
mol,m(CaC2)= mol×64 g/mol=
mol×64 g/mol= g,CaC2的纯度=
g,CaC2的纯度=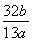 ×100%。
×100%。

25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
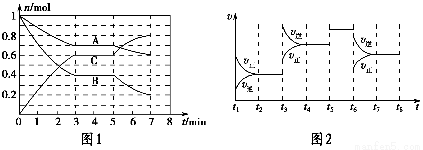
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。