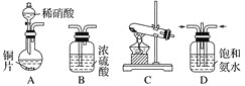
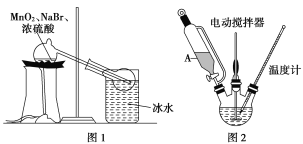
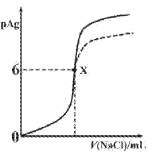
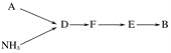题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣的数目为 NA
B.0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
【答案】D
【解析】
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,未指明溶液体积,无法计算Cl﹣的数目,A错误;
B.0.2 mol Fe与足量水蒸气反应3Fe+4H2O(g) 高温Fe3O4+4H2,生成的H2分子数目为![]() NA,B错误;
NA,B错误;
C.标准状况下, H2O为液体,无法通过气体摩尔体积进行计算,C错误;
D.一定条件下Na与一定量氧气反应生成Na2O和Na2O2的混合物,钠元素的化合价均从0价上升为+1价,2.3g钠的物质的量为0.1mol,即转移的电子数一定为0.1NA,D正确;
答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】化学反应原理是研究和学习化学的重要依据。回答下列问题:
(1)已知氢气的燃烧热△H=﹣285.5kJmol﹣1,则电解水的热化学方程式为_____
(2)在298K、101kPa下,2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1,则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量_____198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=_____。
(3)25℃时,下表为一些难溶电解质的相关数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 5.8 | 4.1 | 2.0 |
完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步骤为:
①应先加入_____(填试剂名称),发生的离子反应方程式为_____
②再加入CuO,调节溶液的pH在_____范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。