题目内容
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- | |
| B. | 无色透明的溶液:Cu2+、NH4+、NO3-、CO32- | |
| C. | 0.1 mol•L-1KNO3溶液:Mg2+、Fe3+、Cl-、SO42- | |
| D. | 水电离出的c(H+)=10-12 mol•L-1的溶液:Na+、NH4+、SO42-、NO3- |
分析 A.使pH试纸变红的溶液为碱性溶液,溶液中存在大量氢氧根离子;
B.铜离子为有色离子,铜离子与碳酸根离子反应;
C.四种离子之间不反应,都不与硝酸钾反应;
D.水电离出的c(H+)=10-12 mol•L-1的溶液为酸性或碱性溶液,铵根离子与氢氧根离子反应.
解答 解:A.使pH试纸变红的溶液中存在大量氢氧根离子,Ca2+与氢氧根离子反应生成微溶物氢氧化钙,在溶液中不能大量共存,故A错误;
B.Cu2+、CO32-之间反应,且Cu2+为有色离子,在溶液中不能大量共存,故B错误;
C.Mg2+、Fe3+、Cl-、SO42-之间不反应,都不与KNO3反应,在溶液中能够大量共存,故C正确;
D.水电离出的c(H+)=10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,NH4+与碱性溶液中的氢氧根离子反应,在碱性溶液最后不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的氢离子或氢氧根离子;溶液的颜色,无色时可排除有色离子的存在.

练习册系列答案
相关题目
8.现有室温下的四种溶液,其pH如表所示,下列有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ②③两溶液等体积混合,所得溶液中:c(OH-)>c(H+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L④和V2L①溶液混合后,若pH=7,则V1<V2 |
5.下列化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
12.ClO2是一种消毒杀菌效率高,二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| A. | KClO3中的Cl在反应中失去电子 | |
| B. | 反应中H2C2O4是还原剂 | |
| C. | ClO2是氧化产物 | |
| D. | 生成1molClO2有2 mol电子发生转移 |
2.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)非金属性最强的元素是F;
(2)Ne原子结构示意图为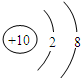 ;
;
(3)N和O中,原子半径较小的是O; (4)H2S和HCl中,热稳定性较强的是HCl;
(5)MgO和Al2O3中,属于两性氧化物的是Al2O3;
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式);
(7)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(8)誉称为“绿色氧化剂”的过氧化氢,它的化学式是H2O2,其中氢元素与氧元素的质量比为m(H):m(O)=1:16;(相对原子质量:H-1,O-16)
(9)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Ne原子结构示意图为
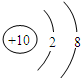 ;
;(3)N和O中,原子半径较小的是O; (4)H2S和HCl中,热稳定性较强的是HCl;
(5)MgO和Al2O3中,属于两性氧化物的是Al2O3;
(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式);
(7)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(8)誉称为“绿色氧化剂”的过氧化氢,它的化学式是H2O2,其中氢元素与氧元素的质量比为m(H):m(O)=1:16;(相对原子质量:H-1,O-16)
(9)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2.
9.下列说法正确的是( )
| A. | c(H+)=c(OH-)的溶液一定呈中性 | |
| B. | 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH>7 | |
| D. | 0.1 mol•L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
6.元素${\;}_{8}^{18}$O的原子核内中子数与质子数之差为( )
| A. | 8 | B. | 10 | C. | 2 | D. | 18 |
 高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题
高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题