题目内容
7. 高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题
高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题(1)实验室制取纯净氯气的实验中,除了二氧化锰、浓盐酸和浓硫酸,还需要饱和氯化钠溶液、氢氧化钠溶液(填写试剂或溶液名称)
(2)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式:2ClO2-+Cl2=2ClO2+2Cl-
(3)图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是c(填“a”“b”或“c”).
(4)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为N2H4,该氢化物与足量盐酸反应的化学反应方程式为N2H4+2HCl=N2H6Cl2.
分析 (1)依据浓盐酸具有挥发性,制取的氯气中含有水蒸气和氯化氢,要想制取纯净的氯气需要除去氯化氢和水蒸气,氯气有毒,过量的氯气应进行尾气处理;
(2)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,依据氧化还原反应得失电子守恒结合原子个数守恒规律解答;
(3)依据氧化还原反应电子守恒分析,同质量的金属,摩尔电子质量越小,生成氢气越多;
(4)H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;依据信息结合常识判断含2个氮原子的分子为肼;肼与HCl反应生成N2H6Cl2,据此解答.
解答 解:(1)浓盐酸具有挥发性,制取的氯气中含有水蒸气和氯化氢,要想制取纯净的氯气需要除去氯化氢和水蒸气,应依次通过盛有饱和食盐水的洗气瓶、浓硫酸的洗气瓶,氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠反应,可以用氢氧化钠吸收过量的氯气,所以除了二氧化锰、浓盐酸和浓硫酸,还需要:饱和氯化钠溶液、氢氧化钠溶液;
故答案为:饱和氯化钠溶液、氢氧化钠溶液;
(2)Cl2氧化NaClO2溶液制取ClO2,反应生成二氧化氯、氯化钠,离子方程式:2ClO2-+Cl2=2ClO2+2Cl-;
故答案为:2ClO2-+Cl2=2ClO2+2Cl-;
(3)依据氧化还原反应电子守恒分析,同质量的金属,摩尔电子质量越小,生成氢气越多,锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系可知,同质量的金属生成氢气越多的,其摩尔电子质量越小,摩尔电子质量分别为:Zn为32.5g/mol,Al为9g/mol,Mg为12/mol,所以同质量的金属铝生成氢气最多,图象中c符合;
故答案为:c;
(4)H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;依据信息结合常识判断含2个氮原子的分子为肼,化学式为:N2H4;肼与HCl反应方程式为N2H4+2HCl=N2H6Cl2,
故答案为:N2H4;N2H4+2HCl=N2H6Cl2;
点评 本题为综合题,考查了氯气的制备、离子方程式的书写,明确氯气制备原理,氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- | |
| B. | 无色透明的溶液:Cu2+、NH4+、NO3-、CO32- | |
| C. | 0.1 mol•L-1KNO3溶液:Mg2+、Fe3+、Cl-、SO42- | |
| D. | 水电离出的c(H+)=10-12 mol•L-1的溶液:Na+、NH4+、SO42-、NO3- |
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
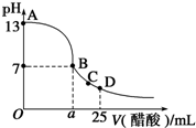
| C. | CH3COOH 溶液加水稀释后,溶液中的$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$值减小 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: | D. | 15N的电子排布式:1s22s22p4 |
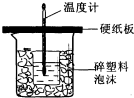 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题: