题目内容
【题目】请认真观察下图,然后回答问题:
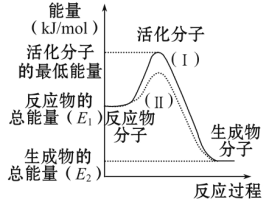
①图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH= kJ/mol(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:________________。
【答案】①放热 需要 E2-E1 ②409 ③使用了催化剂
【解析】
试题分析:①分析图像知该反应反应物的总能量高于生成物的总能量,依据能量守恒分析该反应是放热反应,反应发生需要提供能量达到能量E1使反应物变化为活化分子发生有效碰撞发生反应,反应的焓变△H=生成物总能量-反应物总能量=E2-E1。
②已知热化学方程式:H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能=正反应活化能-反应焓变=167.2KJ/mol-(-241.8KJ/mol)=409.0KJ/mol。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,反应焓变不变,则是使用了催化剂。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
