题目内容
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。

已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
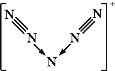
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。

【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 d Na2CO3 H2SiO3、AI(OH)3 加热浓缩、冷却结晶、过滤 2H2O+2e-=2OH-+H2(或2H++2e-=H2) 50%
4Na2CrO4+4CO2 d Na2CO3 H2SiO3、AI(OH)3 加热浓缩、冷却结晶、过滤 2H2O+2e-=2OH-+H2(或2H++2e-=H2) 50%
【解析】
将铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)和纯碱、空气煅烧,发生反应得到NaAlO2、Na2CrO4、Na2SiO3、Na2CO3,然后水浸、过滤得到浸出液,浸出液中溶质是NaAlO2、Na2CrO4、Na2SiO3、Na2CO3 ,在浸出液中利用焙烧产生的二氧化碳调整溶液pH ,依据流程可知,溶液中偏铝酸钠、Na2SiO3生成硅酸沉淀和氢氧化铝沉淀,然后过滤得到滤液和沉淀,沉淀是H2SiO3、AI(OH)3,滤液中含有Na2CrO4和Na2CO3 ,加入酸继续调节溶液的pH ,根据信息②知,溶质变为Na2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体。
(1)根据流程和上述分析,“煅烧’’时,Cr2O3与加入的纯碱、空气高温下反应生成Na2CrO4和二氧化碳,化学反应方程式为:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2;陶瓷、玻璃、石英当中都含有二氧化硅,煅烧时加入的纯碱会与二氧化硅反应,损坏实验装置,因此因该在铁坩埚中进行煅烧操作。
4Na2CrO4+4CO2;陶瓷、玻璃、石英当中都含有二氧化硅,煅烧时加入的纯碱会与二氧化硅反应,损坏实验装置,因此因该在铁坩埚中进行煅烧操作。
答案为:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 ;d
4Na2CrO4+4CO2 ;d
(2)流程图中。“过滤II”后得到溶液中含有Na2CO3,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体后得到的滤液中含有大量Na2CO3可用于煅烧操作。
答案为:Na2CO3;
(3)浸出液中利用焙烧产生的二氧化碳调整溶液pH ,二氧化碳溶于水溶液显酸性,滤液中的偏铝酸钠、Na2SiO3转化为硅酸沉淀和氢氧化铝沉淀。
答案为:H2SiO3、AI(OH)3;
(4)由Na2Cr2O7溶液制备红矾钠固体,操作为蒸发浓缩、冷却结晶、过滤洗涤。
答案为:蒸发浓缩、冷却结晶、过滤;
(5)根据电解池中a电极端,加入稀氢氧化钠,相当于电解水,流出浓氢氧化钠,说明a电极周围产生大量氢氧根离子,因此可得a电极上水中氢离子得到电子转变为氢气和氢氧根,因此电极a为阴极,电极式为2H2O+2e-=2OH-+H2(或2H++2e-=H2);b电极为阳极,溶液中阴离子放电,根据放电顺序氢氧根大于含氧酸根(CrO42-),因此b电极为水中的氢氧根离子失去电子转变为氧气和氢离子,在氢离子存在的情况下,根据已知信息2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012可得,
Cr2O72- +H2O K=1.0×1012可得,![]() ,溶液的pH=6,即
,溶液的pH=6,即![]() =1.0×10-6mol/L,K=
=1.0×10-6mol/L,K=![]() =
=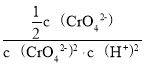 =
=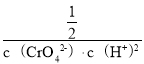 =1.0×1012,
=1.0×1012,![]() =0.5mol/L,因此当溶液pH=6时,溶液中剩余的CrO42-为0.5mol,消耗的CrO42-为0.5mol,Na2CrO4的转化率=
=0.5mol/L,因此当溶液pH=6时,溶液中剩余的CrO42-为0.5mol,消耗的CrO42-为0.5mol,Na2CrO4的转化率=![]() =50%;
=50%;
答案为:2H2O+2e-=2OH-+H2(或2H++2e-=H2);50%;

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案