题目内容
20.下列实验操作中,正确的是( )| A. | 蒸发时垫石棉网可以防止蒸发皿因受热不均匀炸裂 | |
| B. | 酒精灯熄灭点火时可用打火机,熄灭时可轻轻吹灭 | |
| C. | 试管内壁附着的沉淀物一般用盐酸洗涤 | |
| D. | 过滤后洗涤一般2~3次,所加蒸馏水不宜过多 |
分析 A.蒸发皿是耐高温仪器,可以直接加热;
B.打火机中有易燃气体,酒精灯熄灭点火时不可用打火机,熄灭时用灯帽盖灭;
C.要根据沉淀物的性质确定洗涤液;
D.过滤后洗涤一般2-3次,目的是减少沉淀物的损失,且所加蒸馏水没过沉淀即可.
解答 解:A.蒸发皿是耐高温仪器,可以直接加热,不用垫石棉网,但将热的蒸发皿放置在实验桌上时要垫石棉网,故A错误;
B.打火机中有易燃气体,如果用打火机点燃酒精灯,可能引起打火机爆炸,所以酒精灯熄灭点火时不可用打火机,且熄灭时用灯帽盖灭,不能用嘴吹,故B错误;
C.要根据沉淀物的性质确定洗涤液,如:S用CS2洗涤、Ag用硝酸洗涤,故C错误;
D.过滤后洗涤一般2-3次,目的是减少沉淀物的损失,且所加蒸馏水没过沉淀即可,故D正确;
故选D.
点评 本题考查实验基本操作,为高频考点,涉及蒸发、洗涤、酒精灯的使用等知识点,明确实验原理及操作规范性是解本题关键,易错选项是B.

练习册系列答案
相关题目
10.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,14g氮气中含NA个氮原子 | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 18g水中所含的电子数为8NA |
11.120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 2.0 mol•L-1 | B. | 1.5 mol•L-1 | C. | 0.18 mol•L-1 | D. | 0.24 mol•L-1 |
8.下列对于“物质的量”或“摩尔”的理解正确的是( )
| A. | 物质的量是国际科学界建议采用的一种物理量 | |
| B. | 物质的量是摩尔的单位,符号为n | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来的物理量 | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
15.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1mol•L-l FeCl3溶液,0.1mol•L-l FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:2FeCl2+Cl2═2FeCl3.
(2)设计实验方案,完成下列表格.
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为Fe2++Zn═Zn2++Fe.
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:2FeCl2+Cl2═2FeCl3.
(2)设计实验方案,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色_.加入KSCN溶液后,溶液不变色. |
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
3.减少SO2的排放、回收利用SO2已成为世界性的研究课题.我国研究人员设计的利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧废渣产生的SO2来制备硫酸锰的生产流程如图1:

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效果如图2所示.
已知PbO2的氧化性大于MnO2的氧化性.请回答下列问题:
(1)废渣的主要成分是硫铁矿,1molFeS2高温焙烧转移11mol电子.
(2)在氧化后的浸出液中加入石灰浆,用于调节浸出液的pH,pH应调节至4.7~8.3.
(3)阳离子吸附剂用于除去杂质金属离子.决定阳离子吸附剂吸附效果的因素是BCD(填写序号).
A.溶液的pH
B.金属离子的电荷
C.金属离子的半径
D.吸附时间
(4)操作a包括蒸发、浓缩、结晶等过程.

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效果如图2所示.
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 |
(1)废渣的主要成分是硫铁矿,1molFeS2高温焙烧转移11mol电子.
(2)在氧化后的浸出液中加入石灰浆,用于调节浸出液的pH,pH应调节至4.7~8.3.
(3)阳离子吸附剂用于除去杂质金属离子.决定阳离子吸附剂吸附效果的因素是BCD(填写序号).
A.溶液的pH
B.金属离子的电荷
C.金属离子的半径
D.吸附时间
(4)操作a包括蒸发、浓缩、结晶等过程.
20.下表为元素周期表的一部分,请用化学用语回答下列有关问题:
(1)常温下呈液态的单质是Br2;元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素是N;写出元素⑥对应的离子的电子式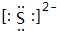 ;①单质的电子式
;①单质的电子式 ;写出⑧的原子结构示意图
;写出⑧的原子结构示意图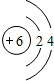 .
.
(2)表中最活泼的金属是K,非金属性最强的元素是F,最高价氧化物对应的水化物酸性最强的酸是HClO4,能形成两性氢氧化物的元素是Al.
(3)由③⑤两元素所形成的原子个数比为1:1的化合物中存在的化学键的种类有离子键、共价键;写出它与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)④⑥⑦⑨元素对应的离子半径从大到小的顺序S2->Cl->K+>Al3+.
(5)元素⑥和⑦对应的单质的氧化性较强的是Cl2,能证明这一结论的一个实验事实Cl2+H2S=S↓+2HCl.
| 元素 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ⑧ | ① | ⑤ | ② | |||
| 三 | ③ | ④ | ⑥ | ⑦ | |||
| 四 | ⑨ | ⑩ |
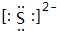 ;①单质的电子式
;①单质的电子式 ;写出⑧的原子结构示意图
;写出⑧的原子结构示意图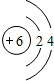 .
.(2)表中最活泼的金属是K,非金属性最强的元素是F,最高价氧化物对应的水化物酸性最强的酸是HClO4,能形成两性氢氧化物的元素是Al.
(3)由③⑤两元素所形成的原子个数比为1:1的化合物中存在的化学键的种类有离子键、共价键;写出它与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)④⑥⑦⑨元素对应的离子半径从大到小的顺序S2->Cl->K+>Al3+.
(5)元素⑥和⑦对应的单质的氧化性较强的是Cl2,能证明这一结论的一个实验事实Cl2+H2S=S↓+2HCl.
1.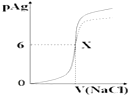 如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI))
如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI))
 如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI))
如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI))| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中x点的坐标为(100,6 ) | |
| C. | 图中x点可认为溶液中Ag+被沉淀完全 | |
| D. | 把0.1 mol•L-1的NaCl换成0.1 mol•L-1NaI则图象在终点后变为虚线部分 |
