题目内容
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
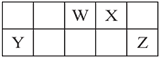
A. 氢化物沸点:W>Z B. 氧化物对应水化物的酸性:Y>W
C. WX2是酸性氧化物 D. 简单离子的半径: Y>X
【答案】A
【解析】根据元素在元素周期表中的相对位置,设W的最外层电子数为x,则X、Y、Z的最外层电子数分别为x+1、x-2、x+2,根据条件可得x=5,故可推断W为N,X为O,Y为Al,Z为Cl;据此分析解题。
NH3分子中存在氢键,所以NH3的沸点高于HCl的沸点,A正确;Y的氧化物对应水化物是Al(OH)3,为两性氢氧化物,W的氧化物对应水化物分别是HNO2、HNO3,均显酸性,所以W的氧化物对应水化物的酸性一定大于Y的氧化物对应水化物的酸性,B错误;Al2O3是离子晶体,熔点较高,AlCl3是分子晶体,熔点相对较低,C错误;离子的电子层数相同时,原子序数越大,半径越小,所以Al3+的半径小于O2-的半径,D错误;正确选项A。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目