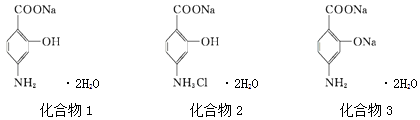
题目内容
【题目】下图是人类从海水资源获取某些重要化工原料的流程示意图:
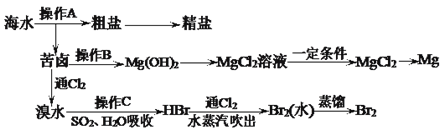
回答下列问题:
(1)操作A是___________和过滤(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上由无水MgCl2制取镁的化学方程式为__________________________________。
(4)0.25 mol Cl2缓慢通入含有0.1 mol FeBr2、0.1 mol FeI2的混合溶液中,充分反应,试用一个离子方程式表示总反应:__________________________________________。
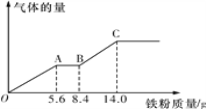
(5)某稀硫酸和稀硝酸的混合溶液100 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。则原混合溶液中NO3-的物质的量为__________,硫酸的物质的量浓度为______________。
【答案】 蒸发结晶 c MgCl2(熔融) ![]() Mg+Cl2↑ 4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl- 0.2 mol 5 mol/L
Mg+Cl2↑ 4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl- 0.2 mol 5 mol/L
【解析】(1)操作A为从海水中获得粗盐和苦卤,由于NaCl的溶解度随温度升高变化不明显,操作A为蒸发结晶和过滤。
(2)操作B为向苦卤中加入一种试剂使苦卤中Mg2+转化为Mg(OH)2沉淀,最合适的试剂是石灰乳。
(3)工业上电解熔融MgCl2制Mg。
(4)还原性I-![]() Fe2+
Fe2+![]() Br-,根据氧化还原反应中“先强后弱”规律计算,再合并书写离子方程式。
Br-,根据氧化还原反应中“先强后弱”规律计算,再合并书写离子方程式。
(5)向稀硫酸和稀硝酸的混合液中加入铁粉,随着铁粉的加入依次发生的反应为Fe+4H++NO3-=Fe3++NO↑+2H2O、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,依据图像中关键点的数据和离子方程式计算。
(1)操作A为从海水中获得粗盐和苦卤,由于NaCl的溶解度随温度升高变化不明显,操作A为蒸发结晶和过滤。
(2)操作B为向苦卤中加入一种试剂使苦卤中Mg2+转化为Mg(OH)2沉淀。a项,NaOH溶液能使Mg2+转化为Mg(OH)2沉淀,但NaOH比较昂贵;b项,澄清石灰水能使Mg2+转化为Mg(OH)2沉淀,但Ca(OH)2微溶于水;c项,石灰乳能使Mg2+转化为Mg(OH)2沉淀,且石灰乳比较便宜;d项,碳酸钠溶液能使Mg2+转化为MgCO3沉淀,MgCO3的溶解度大于Mg(OH)2;最合适的试剂是石灰乳,答案选c。
(3)工业上电解熔融MgCl2制Mg,反应的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。
(4)0.1 mol FeBr2、0.1 mol FeI2的混合溶液中含n(Fe2+)=0.2mol、n(Br-)=0.2mol、n(I-)=0.2mol;还原性I-![]() Fe2+
Fe2+![]() Br-,Cl2先与I-发生反应Cl2+2I-=2Cl-+I2,0.2molI-消耗0.1molCl2生成0.1molI2;与I-反应后余下Cl2为0.25mol-0.1mol=0.15mol,接着发生反应Cl2+2Fe2+=2Fe3++2Cl-,0.2molFe2+消耗0.1molCl2生成0.2molFe3+;Fe2+完全反应后余下Cl2为0.15mol-0.1mol=0.05mol,Cl2继续与Br-发生反应Cl2+2Br-=2Cl-+Br2,0.05molCl2消耗0.1molBr-生成0.05molBr2;反应中消耗的Cl2、I-、Fe2+、Br-物质的量之比为0.25mol:0.2mol:0.2mol:0.1mol=5:4:4:2,反应的离子方程式为5Cl2+4I-+4Fe2++2Br-=10Cl-+2I2+4Fe3++Br2。
Br-,Cl2先与I-发生反应Cl2+2I-=2Cl-+I2,0.2molI-消耗0.1molCl2生成0.1molI2;与I-反应后余下Cl2为0.25mol-0.1mol=0.15mol,接着发生反应Cl2+2Fe2+=2Fe3++2Cl-,0.2molFe2+消耗0.1molCl2生成0.2molFe3+;Fe2+完全反应后余下Cl2为0.15mol-0.1mol=0.05mol,Cl2继续与Br-发生反应Cl2+2Br-=2Cl-+Br2,0.05molCl2消耗0.1molBr-生成0.05molBr2;反应中消耗的Cl2、I-、Fe2+、Br-物质的量之比为0.25mol:0.2mol:0.2mol:0.1mol=5:4:4:2,反应的离子方程式为5Cl2+4I-+4Fe2++2Br-=10Cl-+2I2+4Fe3++Br2。
(5)向稀硫酸和稀硝酸的混合液中加入铁粉,随着铁粉的加入依次发生的反应为Fe+4H++NO3-=Fe3++NO↑+2H2O、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。根据图像OA段加入5.6g铁粉时NO3-完全反应,5.6gFe粉物质的量为0.1mol,根据离子反应Fe+4H++NO3-=Fe3++NO↑+2H2O,此过程中消耗的NO3-、H+物质的量依次为0.1mol、0.4mol;BC段加入5.6g(14.0g-8.4g=5.6g)铁粉将溶液中的H+完全反应,5.6gFe粉物质的量为0.1mol,根据离子反应Fe+2H+=Fe2++H2↑,此过程中消耗H+物质的量为0.2mol;50mL稀硫酸和稀硝酸的混合液中含NO3-物质的量为0.1mol、含H+物质的量为(0.4mol+0.2mol)=0.6mol;则原混合溶液中NO3-物质的量为0.1mol![]() 2=0.2mol,硫酸物质的量为(0.6mol
2=0.2mol,硫酸物质的量为(0.6mol![]() 2-0.2mol)
2-0.2mol)![]() 2=0.5mol,硫酸物质的量浓度为0.5mol
2=0.5mol,硫酸物质的量浓度为0.5mol![]() 0.1L=5mol/L。
0.1L=5mol/L。

 寒假乐园北京教育出版社系列答案
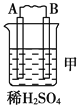
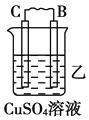
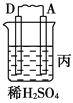
寒假乐园北京教育出版社系列答案【题目】Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_______________,装置乙中正极的电极反应式是___________。
(2)四种金属活泼性由强到弱的顺序是_____________________________________。
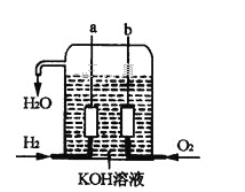
Ⅱ.美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中a、b两个电极均由多孔的碳炔组成,该电池的负极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为________mol。