题目内容
切开的金属Na暴露在空气中,其变化过程如下:
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
| A.升高温度,溶液的pH降低 |
| B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3) |
| C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大 |
| D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+) |
① 钠比锂活泼,用原子结构解释原因_______。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na
 Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)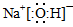 (3)B C
(3)B C
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na++ 2e-=Ni +2NaCl
解析试题分析:(1)①由于反应物的总能量比生成物的总能量高,所以发生的反应Ⅰ是放热反应。② 由题目提供的能量关系可得该反应的热化学方程式为:Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol。(2)反应Ⅱ是Na2O与水的反应,Na2O与水反应产生NaOH,反应的方程式为Na2O+H2O =2NaOH。NaOH的电子式为: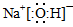 。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O
。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)=" 2" c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O
NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)=" 2" c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O NaHCO3+ NaOH逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32-
NaHCO3+ NaOH逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32- OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O
OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O H++ OH―。所以c c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na++ 2e-=Ni +2NaCl;负极的电极式为2Na-2e-=2Na+.
H++ OH―。所以c c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na++ 2e-=Ni +2NaCl;负极的电极式为2Na-2e-=2Na+.
考点:考查物质的能量与反应热的关系、热化学方程式和物质的电子式的书写、盐的水解、离子浓度的大小比较、原电池反应原理的知识。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下: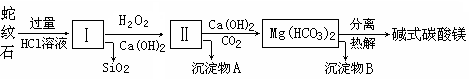
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 溶液,然后过滤、洗涤、 _________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:
(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
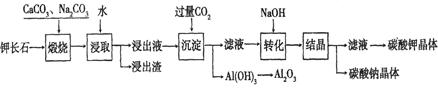
 Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。
Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。