题目内容
NaCI是一种化工原料,可以制备一系列物质 (见下图)。下列说法正确的是
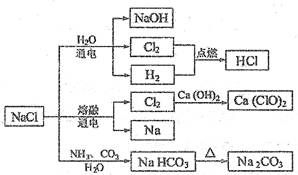

| A.常温时,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应可用于制备漂白粉,漂白粉的主要成分是Ca(ClO)2和CaCl2 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
B
A、一般酸式盐溶解度大于正盐,但碳酸盐相反;
C、常温下反应慢,但在一定条件下可以剧烈反应;
D、制纯碱的反应为非氧化还原反应。
C、常温下反应慢,但在一定条件下可以剧烈反应;
D、制纯碱的反应为非氧化还原反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
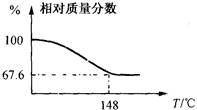
 量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。
量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。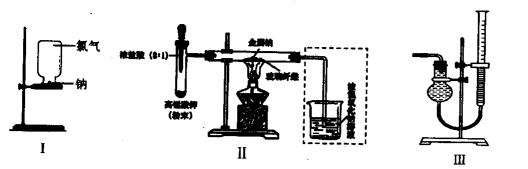
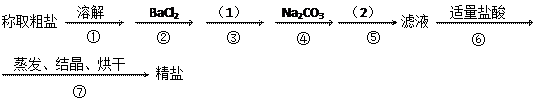
 ②和④可否颠倒_
②和④可否颠倒_ 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是: