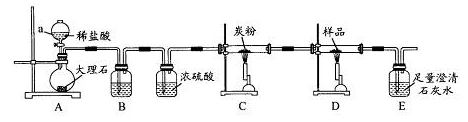
题目内容
甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-)离子。向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
| A.Br-、Cl-、I- | B.I-、Br-、Cl- | C.Br-、I-、Cl- | D.Cl-、I-、Br- |
C
解析试题分析:向甲中加淀粉溶液和氯水,则溶液变为橙色,发生Cl2+2Br-=Br2+2Cl-,则甲中含有溴离子;再加入丙溶液,颜色无明显变化,因氯气能氧化碘离子,则丙中不含碘离子,即丙中含氯离子,甲、乙、丙三种溶液各含有一种离子,则乙中含碘离子,所以甲、乙、丙依次含有Br-、I-、Cl-。
考点:考查氯、溴、碘及其化合物的综合应用;氧化性、还原性强弱的比较等相关知识。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )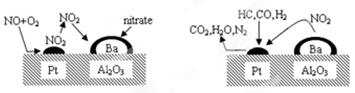
| A.汽车尾气催化转化机理 | B.钢铁生锈机理 |
| C.合成氨工业催化氧化机理 | D.氢氧燃烧电池电极反应机理 |
向淀粉溶液中分别加入下列物质,能使溶液变蓝的是
| A.氯水 | B.溴水 | C.碘化钾 | D.碘水 |
下列措施不合理的是
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
D.用Na2S作沉淀剂,除去废水中的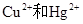 |
海带中的碘元素是以I-的形式存在的,为将I-转化成I2并提取出来,设计操作步骤如下:①通入Cl2;②将海带烧成灰,向灰中加水,搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序为( )
| A.①③⑤②④ | B.②①③④⑤ | C.②④①③⑤ | D.③①②⑤④ |
将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3- 的物质的量为
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a)mol |
下列实验中,颜色的变化与氧化还原反应无关的是
| A.SO2使酸性KMnO4溶液褪色 |
| B.Na2O2投入酚酞溶液中溶液先变红后褪色 |
| C.向FeSO4溶液中滴NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 |
| D.往紫色石蕊试液中通入氨气,溶液变蓝 |
下列说法不正确的是
| A.2013年0点钟声敲响后的几个小时,北京的污染指数从轻度污染上升为重度污染,主要污染为PM2.5污染,看来烟花爆竹的燃放,可加重PM2.5污染 |
| B.催化剂之所以能加快反应速率,是因为催化剂能降低反应的活化能 |
| C.氨气的水溶液氨水可以导电,因此氨气是电解质 |
| D.大量燃烧含硫燃料是形成酸雨的主要原因 |