题目内容
7.下列氧化还原反应中,水做还原剂的是( )| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═NO+2HNO3 | ||
| C. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+H2 | D. | 2F2+2H2O═4HF+O2 |
分析 反应中水做还原剂,且还属于氧化还原反应,说明该反应中有电子转移且水中元素化合价升高,据此分析解答.
解答 解:A.2Na+2H2O=2NaOH+H2↑中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,所以水是氧化剂,故A错误;
B.3NO2+H2O═NO+2HNO3中水中各元素化合价不变,所以水既不是氧化剂又不是还原剂,故B错误;
C.CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+H2中CO中C元素化合价由+2价变为+4价,水中H由+1变成0价,所以水是氧化剂,故C错误;
D.2F2+2H2O═4HF+O2中F2中F元素化合价由0价变为-1价,水中O由-2变成0价,所以水是还原剂,故D正确;
故选D.
点评 本题考查氧化还原反应和氧化剂、还原剂的判断,侧重考查基本概念,明确元素化合价变化是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.除去溴苯中少量溴的方法是( )
| A. | 加入苯使之反应 | B. | 加入较大量的CCl4萃取静置后分液 | ||
| C. | 加入KI溶液 | D. | 加入较大量NaOH溶液后静置分液 |
15.已知:H2(g)+F2(g)═2HF(g),反应过程的能量变化如下图,下列说法正确的是( )


| A. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| B. | 氟化氢气体分解生成氢气和氟气的反应是吸热反应 | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 其它条件不变,加入催化剂,该反应的△H减小 |
2.将碘酒滴到一片土豆上,可观察到土豆变蓝,说明土豆中含有( )
| A. | 醋酸 | B. | 淀粉 | C. | 葡萄糖 | D. | 纤维素 |
12.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | NaCl溶液中滴入AgNO3溶液 | B. | 氢气还原氧化铜 | ||
| C. | 铁片置于CuSO4溶液中 | D. | 一氧化碳的燃烧 |
19.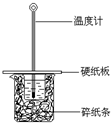 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )| A. | 实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若将盐酸体积改为60 mL,理论上所求中和热不相等 |
16.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现
①Si(固)+3HCl(气)$\frac{\underline{\;300℃\;}}{\;}$ SiHCl3(气)+H2(气)
②SiHCl3+H2 $\frac{\underline{\;950℃\;}}{\;}$Si+3HCl
对上述两个反应的叙述中,错误的是( )
①Si(固)+3HCl(气)$\frac{\underline{\;300℃\;}}{\;}$ SiHCl3(气)+H2(气)
②SiHCl3+H2 $\frac{\underline{\;950℃\;}}{\;}$Si+3HCl
对上述两个反应的叙述中,错误的是( )
| A. | 两个反应都是置换反应 | B. | 据反应条件无法判断反应是否吸热 | ||
| C. | 两个反应互为可逆反应 | D. | 两个反应都是氧化还原反应 |