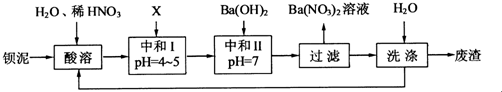
题目内容
15.已知:H2(g)+F2(g)═2HF(g),反应过程的能量变化如下图,下列说法正确的是( )
| A. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| B. | 氟化氢气体分解生成氢气和氟气的反应是吸热反应 | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 其它条件不变,加入催化剂,该反应的△H减小 |
分析 由热化学方程式可知,正反应△H<0,为放热反应,说明反应物总能量大于生成物总能量,以此解答该题.
解答 解:A.物质由气体变为液体放出能量,则1mol H2与1mol F2反应生成2mol液态HF放出的热量大于270kJ,故A错误;
B.由热化学方程式可知,正反应△H<0,为放热反应,则逆反应氟化氢气体分解生成氢气和氟气的反应是吸热反应,故B正确;
C.由热化学方程式可知,正反应△H<0,为放热反应,说明反应物总能量大于生成物总能量,故C正确;
D.△H只与反应物的系数以及状态有关,所以加入催化剂,该反应的△H不变,故D错误.
故选BC.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握物质的能量与反应热的关系,把握热化学方程式的特点,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
6. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴中心是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成 Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉铁板,在铜铁接触处滴加NaCl溶液,则负极:Fe-2e-═Fe2+ |
3.环境保护是当下人类最重要的课题,下列说法中不正确的是( )
| A. | 垃圾分类并回收利用,符合可持续发展的要求,是垃圾处理的发展方向 | |
| B. | 人类活动排入大气的氟氯代烷和含溴的卤代烃能使臭氧层受到破坏 | |
| C. | 防止水体污染和改善水质最根本的措施是控制工业废水和生活污水的排放 | |
| D. | 目前常用的垃圾处理方法有卫生填埋、堆肥和焚烧,这些方法对环境无污染 |
10.宜兴竹海风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g | C. | 33 g•molˉ1 | D. | 32 g•molˉ1 |
20.下列材料中,不属于通常所说的三大合成材料的是( )
| A. | 塑料 | B. | 合成纤维 | C. | 蛋白质 | D. | 合成橡胶 |
7.下列氧化还原反应中,水做还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═NO+2HNO3 | ||
| C. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+H2 | D. | 2F2+2H2O═4HF+O2 |
4.工业上生产苯乙烯是利用乙苯在560℃时的脱氢反应:
C8H10(g)?C8H8(g)+H2(g)
(乙苯) (苯乙烯)
针对上述反应,有人提出如下观点,其中合理的是( )
C8H10(g)?C8H8(g)+H2(g)
(乙苯) (苯乙烯)
针对上述反应,有人提出如下观点,其中合理的是( )
| A. | 在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率 | |
| C. | 在反应达到平衡过程中,体系的平均相对分子质量在不断增大 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件 |