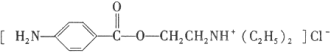题目内容
【题目】有A、B、C、D、E5种短周期元素,A与B可形成BA型化合物,A元素的单质常用于自来水消毒;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4。
(1)写出下列元素的元素名称:A ,B 。
(2)写出C1、C3两种原子的符号:C1 ,C3 。
(3)A、B、E形成的一种化合物是某种家用消毒液的有效成分,其电子式是 。
(4)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是 ,其所含化学键的类型是 ,由最常见的E原子与C2原子形成的最简单分子0.5mol中,所含中子的数目是 。
(5)C、E的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,其正极的电极反应式为 。
【答案】(1)氯(1分)钠(1分)(2)![]() H(1分)
H(1分)![]() H(1分)
H(1分)
(3)![]() (1分)
(1分)
(4)NH4NO3(1分)离子键、共价键(2分)5NA(1分)
(5)O2+2H2O+4e-=4OH-(2分)
【解析】试题分析:A元素的单质常用于自来水消毒,则A为Cl元素,A元素是非金属性最强的元素,则A是F元素。金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,所以根据化学式BA可知,B是第IA元素,所以B是Na元素。C元素有三种同位素C1,C2,C3,自然界里含最多的是C1,C3的质量数是C1的3倍,C2的原子的质量数是C1的2倍,由此可知,C是氢元素。D的气态氢化物的水溶液呈碱性,氨气溶于水显碱性,所以D是氮元素。E元素原子的最外层电子数比次外层电子数多4个,说明E是氧元素。
(1)根据上述分析,元素A和B的元素名称分别为氯、钠。
(2)C1、C3分别为氕和氚,两种原子的符号为![]() H、
H、![]() H。
H。
(3)A、B、E形成的一种化合物是家用消毒液的有效成分,该物质是NaClO,其电子式是![]() 。
。
(4)根据上述分析,D为N元素,N的最高价氧化物的水化物是硝酸,其氢化物是NH3,两者反应形成化合物硝酸铵,硝酸铵的化学式是NH4NO3,其所含化学键的类型是离子键和共价键,E为氧元素,由最常见的O原子与D原子形成的最简单分子为D2O,一个D2O分子中有10个中子,则0.5molD2O中,所含中子的数目是5NA。
(5)C、E的单质为氢气和氧气,氢气和氧气在KOH溶液中可形成燃料电池,氧气在正极得电子生成OH-,则正极的电极反应式为O2+2H2O+4e-=4OH-。

 名校课堂系列答案
名校课堂系列答案