题目内容
【题目】把300 mL含有氯化钡和氯化钠的混合溶液分成三等份,取一份加入含x mol硫酸钾的溶液,恰好使钡离子完全沉淀;另取一份加入含y mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钠离子的物质的量浓度为( )
A.0.1(y-2x)mol/L B.10(2x-y)mol/L
C.20.10(y-x)mol/L D.10(y-2x)mol/L
【答案】D
【解析】
试题分析:先设每份混合溶液中BaCl2、NaCl分别为a mol、b mol,再由BaCl2+K2SO4=BaSO4↓+2KCl中BaCl2、K2SO4的系数之比等于n之比可知,a = x;然后由BaCl2+2AgNO3=2AgCl+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3中两反应物的系数之比等于n之比可知,2a+b=y;再由a = x、2a+b=y可知,b=y-2x;然后原溶液分成三等份,说明原溶液中含有的NaCl为3b mol,亦即3(y-2x)mol;再由![]() 可知,c(NaCl) =
可知,c(NaCl) =![]() mol/L = 10(y-2x)mol/L;最后由电离方程式NaCl=Na++Cl-可知,c(Na+) =c(NaCl) =10(y-2x)mol/L,D正确;答案选D。
mol/L = 10(y-2x)mol/L;最后由电离方程式NaCl=Na++Cl-可知,c(Na+) =c(NaCl) =10(y-2x)mol/L,D正确;答案选D。

【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放.某含汞酸性废水(主要含Hg2+、H+、Na+、Cl﹣等)的处理工艺流程如图所示.
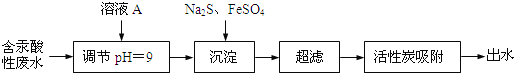
请回答:
(1)含汞废水未经处理直接排放的危害是(填字母) .
a.造成水体污染 b.引起人体中毒
(2)调节废水pH时加入的溶液A可能是(填字母) .a.盐酸b.NaOH溶液
(3)Na2S与Hg2+发生反应的离子方程式是 .
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl﹣ | SO42﹣ |
浓度(mol/L) | 3.0×10﹣4 | 2.0×10﹣4 | 2.5×10﹣4 |
则c(Fe2+)= mol/L.
【题目】
选项 | 物质 | 杂质 | 试剂 | 操作方法 |
A | 二氧化碳 | 一氧化碳 | 氢氧化钠溶液和浓硫酸 | 洗气 |
B | 硫酸钡 | 碳酸钡 | 足量的稀硫酸 | 溶解、过滤、洗涤、烘干 |
C | 氯化钙溶液 | 消石灰 | 过量的二氧化碳 | 过滤、蒸发、结晶 |
D | 氨气 | 水 | 火碱溶液 | 通过盛有火碱溶液的洗气瓶 |