题目内容
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
【答案】四面体形V形![]() sp先生成蓝色絮状沉淀,继续滴加沉淀溶解得深蓝色溶液Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-
sp先生成蓝色絮状沉淀,继续滴加沉淀溶解得深蓝色溶液Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-
【解析】
(1)NH3中心原子N有3个σ键,孤电子对数为(5-3)/2=1,价层电子对数为4,VSEPR模型为四面体形;SO2中性原子S有2个σ键,孤电子对数为![]() =1,价层电子对数为3,空间构型为V形;(2)与CN-等电子体的是N2,根据N2的电子式,推出CN-的电子式为
=1,价层电子对数为3,空间构型为V形;(2)与CN-等电子体的是N2,根据N2的电子式,推出CN-的电子式为![]() ;与SCN-等电子体的是CO2,中心原子的杂化类型为sp;(3)CuSO4溶液中滴加氨水至过量,发生的离子反应方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-,现象是先有蓝色沉淀产生,继续滴加蓝色沉淀消失,溶液变为深蓝色溶液;Cu2+与NH3之间以配位键的结合,即结构简式为
;与SCN-等电子体的是CO2,中心原子的杂化类型为sp;(3)CuSO4溶液中滴加氨水至过量,发生的离子反应方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-,现象是先有蓝色沉淀产生,继续滴加蓝色沉淀消失,溶液变为深蓝色溶液;Cu2+与NH3之间以配位键的结合,即结构简式为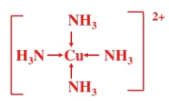 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

