题目内容
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
【答案】3d34s2 VO2 高 4 sp3、sp2 O>N>C>H ![]()
![]()
【解析】
(1)钒是23号元素,根据能量最低原理写出外围电子排布式;
(2)根据均摊法计算晶胞中V、O原子数目,进而确定化学式。VO2 是离子晶体,其熔沸点比分子晶体邻苯二甲酸酐的熔沸点要高。
(3)①单键为σ键,双键含有1个σ键、1个π键;
②甲基上的碳形成4个σ键,为sp3、双键上的碳形成3个σ键,一个π键,为sp2杂化;
③非金属性越强,电负性越大;
④形成4个σ键,没有孤对电子的粒子;
(4)结合原子数目表示出晶胞质量,再根据ρ=m/V计算晶胞密度。
(1)钒的基态原子的外围电子排布式为3d34s2 ;
(2)由晶胞结构可知,含钒原子8×1/8+1=2,O为4×1/2+2=4,该氧化物的化学式为VO2 ,VO2 是离子晶体,其熔沸点比分子晶体邻苯二甲酸酐的熔沸点要高。
(3)①由五氧化二钒的结构图:单键为σ键,双键含有1个σ键、1个π键,可得出含有4个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为:甲基上的碳形成4个σ键,为sp3、双键上的碳形成3个σ键,一个π键,为sp2杂化。
③非金属性越强,电负性越大;H、C、N、O四元素,其电负性从大到小的顺序依次为O>N>C>H。
④形成4个σ键,没有孤对电子的粒子,与![]() 空间构型相同的一种阳离子:NH4+。
空间构型相同的一种阳离子:NH4+。
(4)晶胞中钒原子个数为8×1/8+1=2,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为ρ=m/V=![]() g·cm-3。
g·cm-3。

【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
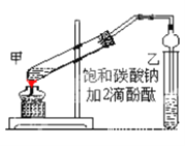
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:________________________;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________________________。
(2)甲试管中,混合溶液的加入顺序:________________________;
(3)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(4)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇
B. 反应掉乙酸并吸收乙醇
C. 乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D. 加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有____________(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸。
(7)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2mL乙醇、1mL乙酸、3mL 18mol·L1浓硫酸 | 饱和Na2CO3溶液 | 3. 0 |
B | 2mL乙醇、1mL乙酸、3mL H2O | 0. 1 | |
C | 2mL乙醇、1mL乙酸、3mL 2mol·L1 H2SO4 | 0. 6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0. 6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和________mol·L1。
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(8)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为。___________(产率%=(实际产量/理论产量)×100%)