题目内容
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的 (不必选其他酸性物质)。请据此回答:
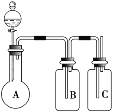
(1)圆底烧瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为______________。
(2)装置B所盛的试剂是_________________,其作用是__________________________。
(3)装置C所盛试剂是___________________,C中反应的离子方程式是_____________________________。
(4)由此可得出的结论是:酸性:__________________>_________________>_____________________。
【答案】盐酸 饱和NaHCO3溶液 吸收HCl气体 Na2SiO3溶液 CO2+SiO32-+H2O=CO32-+H2SiO3↓ HCl H2CO3 H2SiO3
【解析】
根据较强酸制取较弱酸可知,较强酸能和较弱酸盐反应生成较弱酸,较弱酸能制取更弱的酸,要想验证HCl、H2CO3、H2SiO3的酸性强弱,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,根据实验现象确定酸的相对强弱,据此分析解答。
(1)用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,因此分液漏斗中的试剂为盐酸;
(2)盐酸有挥发性,导致二氧化碳气体中含有HCl,会对实验造成干扰,所以B装置要盛放能除去HCl,且不能产生新的杂质、不能和二氧化碳反应的药品,一般常用饱和碳酸氢钠溶液,作用是除去二氧化碳中混有的HCl;
(3)根据以上分析可知C为硅酸钠溶液,二氧化碳和硅酸钠溶液反应生成碳酸钠和硅酸沉淀,反应的离子方程式为CO2+SiO32-+H2O=CO32-+H2SiO3↓。
(4)根据较强酸制备较弱酸可知得出的结论是酸性HCl>H2CO3>H2SiO3。