题目内容
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式:MnO4-+NO2-+X —— Mn2++NO3-+H2O , 下列叙述中正确的是
| A.该反应中NO2-被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.X表示的粒子是OH- |
C
解析试题分析:该反应中锰元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,结合元素守恒、硝酸钠和高锰酸钾之间的关系式分析解答。A、该反应中N元素化合价由+3价变为+5价,所以亚硝酸根离子失电子被氧化,故A错误;B、根据元素守恒、电荷守恒知,X是H+,氢离子参加反应导致溶液中氢离子浓度降低,则溶液的pH增大,故B错误;C、根据转移电子守恒得,生成1molNaNO3需消耗KMnO4的物质的量= =0.4mol,故C正确;D、根据元素守恒、电荷守恒知,X是H+,故D错误,答案选C。
=0.4mol,故C正确;D、根据元素守恒、电荷守恒知,X是H+,故D错误,答案选C。
考点:考查氧化还原反应的有关判断与计算

下列实验的现象与对应的结论均正确的是
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液 | 上层溶液不变红, 下层溶液紫红色 | 氧化性:Br2>Fe3+>I2 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 向漂白粉上加入较浓的盐酸,将湿润淀粉碘化钾试纸置于试管口 | 产生气泡,试纸未变蓝 | 漂白粉已经失效 |
电视剧中所需的大量白烟是用NH4NO3和Zn粉按质量比16:13混合放于温热的石棉网上,使用时滴水数滴产生的。又知发生反应后有N2和水生成。有关的说法中正确的是①水起着溶解NH4NO3、发生吸热现象以及启动反应发生的作用;②1molNO3-在反应中得5mol e-;③成烟物质是氧化锌小颗粒;④NH4+是氧化剂
| A.①② | B.②③ | C.③④ | D.①④ |
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S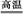 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2 (SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
下列工业生产的反应原理不涉及氧化还原反应的是( )
| A.钢铁厂高炉炼铁 |
| B.工业上以氨气为原料用氨碱法生产纯碱 |
| C.硝酸厂以氨气为原料制取硝酸 |
| D.氯碱厂利用氯化钠生产氯气和烧碱 |
做好环境消毒工作是预防“禽流感”的重要措施,常用的一种消毒剂是ClO2,实验室可通过以下反应制得ClO2(未配平):KClO3+H2C2O4+H2SO4―→ClO2↑+K2SO4+CO2↑+H2O。下列说法正确的是( )
| A.H2SO4在反应中作氧化剂 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 |
| D.1 mol KClO3参加反应时有2 mol电子转移 |
京沪高铁铺设的铁轨为稀土钢轨。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体。已知:铈常见的化合价为+3和+4,且Ce4++Fe2+=Ce3++Fe3+。下列说法正确的是( )。
| A.用惰性电极电解Ce(SO4)2溶液,可在阴极获得铈 |
| B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为Ce4++Fe2+=Ce3++Fe3+ |
| C.金属铈着火时,可用沙土盖灭 |
| D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源 |
下列有关说法不正确的是( )
| A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
C.N(NO2)3( )既有氧化性又有还原性 )既有氧化性又有还原性 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
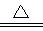 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。 FePO4之间的转化,电池放电时负极发生的反应为Li
FePO4之间的转化,电池放电时负极发生的反应为Li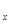 C6-
C6-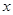 e—
e—