题目内容
下列实验的现象与对应的结论均正确的是
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液 | 上层溶液不变红, 下层溶液紫红色 | 氧化性:Br2>Fe3+>I2 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 向漂白粉上加入较浓的盐酸,将湿润淀粉碘化钾试纸置于试管口 | 产生气泡,试纸未变蓝 | 漂白粉已经失效 |
D
解析试题分析:A、检验NH4+需要用浓NaOH溶液并加热,稀NaOH溶液不能使NH3挥发出来,错误;B、滴加CCl4,下层溶液紫红色,说明Br2氧化I?生成了I2,上层溶液不变红,无法证明Br2与Fe3+的氧化性,错误;C、将水蒸气通过灼热的铁粉,铁与水蒸气反应生成Fe3O4,Fe3O4为黑色,现象错误;D、产生气泡,湿润淀粉碘化钾试纸未变蓝,说明产生的气体不是Cl2,则漂白粉已经失效,正确。
考点:本题考查物质的性质和反应现象及分析。

新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:
则下列判断正确的是
| A.MFe2Ox是还原剂 |
| B.SO2是该反应的催化剂 |
| C.x>y |
| D.SO2发生了置换反应 |
NaNO2有像食盐一样的外观和咸味,它对人体的毒性表现为:可将正常的血红蛋白变为高铁血红蛋白(使血红蛋白中的铁元素由二价变为三价),失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。下列有关NaNO2毒性分析正确的是
| A.因解毒剂美蓝具有氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒时血红蛋白分子被还原 |
根据表中信息判断,下列选项正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
| ② | C12、FeBr2 | FeC13、FeBr3 |
| ③ | MnO4-…… | C12、Mn2+…… |
A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式:MnO4-+NO2-+X —— Mn2++NO3-+H2O , 下列叙述中正确的是
| A.该反应中NO2-被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.X表示的粒子是OH- |
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 molL-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是 ( )。
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是( )。
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |
甲、乙、丙三种溶液各含一种X-(X-为Cl-、Br-、I-),向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化。则甲、乙、丙中依次含有( )
| A.Br-、Cl-、I- | B.Br-、I-、Cl- |
| C.I-、Br-、Cl- | D.Cl-、I-、Br- |
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
| A.(a+3b) mol | B.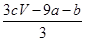 mol mol |
C.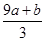 mol mol | D.(cV-3a-9b) mol |