题目内容
电视剧中所需的大量白烟是用NH4NO3和Zn粉按质量比16:13混合放于温热的石棉网上,使用时滴水数滴产生的。又知发生反应后有N2和水生成。有关的说法中正确的是①水起着溶解NH4NO3、发生吸热现象以及启动反应发生的作用;②1molNO3-在反应中得5mol e-;③成烟物质是氧化锌小颗粒;④NH4+是氧化剂
| A.①② | B.②③ | C.③④ | D.①④ |
B
解析试题分析:用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,换算物质的量之比= :
: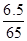 =1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
=1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
考点:考查氧化还原反应的产物判断和电子守恒的应用。

NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式:MnO4-+NO2-+X —— Mn2++NO3-+H2O , 下列叙述中正确的是
| A.该反应中NO2-被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.X表示的粒子是OH- |
甲、乙、丙三种溶液各含一种X-(X-为Cl-、Br-、I-),向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化。则甲、乙、丙中依次含有( )
| A.Br-、Cl-、I- | B.Br-、I-、Cl- |
| C.I-、Br-、Cl- | D.Cl-、I-、Br- |
已知Cu+在酸性条件下能发生下列反应:Cu+ Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中铜元素全部被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合溶液。已知某200 mL的1 mol/L硫酸溶液中含有0.6 mol/L NaNO3,理论上最多溶解Cu的质量是( )
| A.19.2 g | B.11.52 g | C.5.76 g | D.9.6 g |
下列说法正确的是 ( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 |
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是( )
2Na2FeO4+Na2O,下列说法正确的是( )
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
有如下变化:A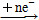 An- ΔH1<0,B
An- ΔH1<0,B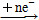 Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
| A.氧化性:A<B | B.还原性:An-<Bn- |
| C.稳定性:B<A | D.稳定性:An-<Bn- |
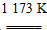 aTiCl4+cCO
aTiCl4+cCO Ti+2MgCl2
Ti+2MgCl2