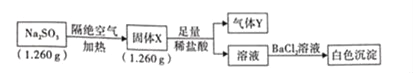
题目内容
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=[c4(C)·c2(D)]/[c3(A)·c2(B)]
B. 0~5 min内A的反应速率为0.24 mol·L-1·min-1
C. 此时B的平衡转化率是40%
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
【答案】C
【解析】
A.根据阿伏加德罗定律及其推论可知,相同温度和体积时气体的压强与气体物质的量成正比,故有![]() ,n后=
,n后=![]() ×n前=
×n前=![]() ×(4+2)mol=5.6mol,正反应气体体积减小且气体减小的物质的量=(4+2)mol-5.6mol=0.4mol,C、D中只能一种物质是气体。若只有C是气体,则反应后气体减小的物质的量=
×(4+2)mol=5.6mol,正反应气体体积减小且气体减小的物质的量=(4+2)mol-5.6mol=0.4mol,C、D中只能一种物质是气体。若只有C是气体,则反应后气体减小的物质的量=![]() ×1.6mol=0.4mol;若只有D是气体,则反应后气体减小的物质的量=
×1.6mol=0.4mol;若只有D是气体,则反应后气体减小的物质的量=![]() ×1.6mol=2.4mol,因此只能C是气体,原反应式为3A(g)+2B(g)
×1.6mol=2.4mol,因此只能C是气体,原反应式为3A(g)+2B(g)![]() 4C(g)+2D(s或l),该反应的化学平衡常数表达式K=
4C(g)+2D(s或l),该反应的化学平衡常数表达式K=![]() ,A项错误;
,A项错误;
B.根据化学计量数可知0~5min内消耗A的物质的量=![]() ×1.6mol=1.2mol,则0~5min内A的反应速率=
×1.6mol=1.2mol,则0~5min内A的反应速率=![]() ,B项错误;
,B项错误;
C.根据化学计量数知此时消耗B的物质的量=![]() ×1.6mol=0.8mol,则B的平衡转化率=
×1.6mol=0.8mol,则B的平衡转化率=![]() ×100%=40%,C项正确;
×100%=40%,C项正确;
D.根据勒夏特列原理和化学方程式可知,增大该体系的压强,平衡向正反应方向(即向右)移动,但化学平衡常数不变,因为化学平衡常数只与温度有关,与压强无关,D项错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 30℃ |
B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
A. AB. BC. CD. D
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
【题目】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度/℃ | c(NH3·H2O) /(mol·L-1) | 电离常数 | 电离度/% | c(OH-) /(mol·L-1) |
0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:![]()
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是________(填字母)。
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是__________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是________。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠