题目内容
4. W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界.
W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界.(1)W原子价电子的轨道表达式为
 .
.(2)WX的等电子体有N2、CN-等.WN-与WX均为配合物中常见的配体,WN-作配体时,提供孤电子对的通常是W原子而不是氮原子,其原因是碳元素的电负性小于氮元素的电负性.
(3)ZX2的空间构型是V形.
(4)YF4遇水易发生水解,水解后产生的HF与部分YF4生成配离子YF62-,其反应的化学方程式为:3YF4+4H2O═H4YO4+2H2YF6.该反应混合物中,中心眼子杂化方式相同的分子是SiF4、H2O、H4SiO4.
(5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到.其中硅原子的配位数为4;己知该晶体的密度为ag/cm3,则该晶胞的棱长为$\root{3}{\frac{480}{a{N}_{A}}}$×1010pm(用含a、NA的代数式表示).
分析 W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,则W为C元素;W与Y同主族,则Y为Si元素;Y元素以Y-X-Y链化合物构成了矿物界,则X为O元素;X与Z同主族,则Z为S元素;
(1)碳原子最外层有4个电子;
(2)原子数和价电子数都相同的微粒互为等电子体;碳元素的电负性小于氮元素的电负性,碳原子对孤电子对的吸引能力较弱;
(3)根据价层电子对数判断;
(4)先判断中心原子的价层电子对数,再判断杂化方式均;
(5)二氧化硅晶体中每个Si原子周围连接4个O原子;该晶胞中Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,O原子数目为16,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为$\frac{60×8}{{N}_{A}}$=$\frac{480}{{N}_{A}}$,根据V=$\frac{m}{ρ}$计算体积,再计算立方体的棱长.
解答 解:W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,则W为C元素;W与Y同主族,则Y为Si元素;Y元素以Y-X-Y链化合物构成了矿物界,则X为O元素;X与Z同主族,则Z为S元素;
(1)碳原子的最外层为L层,L层有4个电子,2个在2S上,2个在2P上,且自旋相同,碳的原子价电子的轨道表达式为 ;
;
故答案为: ;
;
(2)CO中有2个原子、价电子为4+6=10,N2、CN-均与CO互为等电子体;CN-作配体时,提供孤电子对的通常是C 原子而不是氮原子,因为碳元素的电负性小于氮元素的电负性,碳原子对孤电子对的吸引能力较弱;
故答案为:CN-;碳元素的电负性小于氮元素的电负性;
(3)SO2中S原子的价层电子对数为2+$\frac{6-2×2}{2}$=3,含有一个孤电子对,则空间构型是V形;
故答案为:V形;
(4)SiF4遇水易发生水解,水解后产生的HF与部分SiF4生成配离子SiF62-,其反应的化学方程式为:3SiF4+4H2O═H4SiO4+2H2SiF6.该反应混合物中,SiF4、H2O、H4SiO4的中心原子的价层电子对数均为4,杂化方式均为sp3杂化;
故答案为:SiF4、H2O、H4SiO4;
(5)二氧化硅晶体中每个Si原子周围连接4个O原子,则硅原子的配位数为4;该晶胞中Si原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,O原子数目为16,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为$\frac{60×8}{{N}_{A}}$=$\frac{480}{{N}_{A}}$,已知该晶体的密度为ag/cm3,则V=$\frac{m}{ρ}$=$\frac{\frac{480}{{N}_{A}}}{a}$cm3,则该晶胞的棱长为$\root{3}{\frac{480}{a{N}_{A}}}$×1010pm;
故答案为:4;$\root{3}{\frac{480}{a{N}_{A}}}$×1010.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电子排布、杂化类型的判断等知识点,明确物质结构、杂化理论、原子结构等知识点是解本题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | 多糖、蛋白质都是高分子化合物,一定条件下都能水解 | |
| B. | 普通玻璃、钢化玻璃和有机玻璃都是硅酸盐制品 | |
| C. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| D. | 尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的 |
| A. | 能溶于水 | B. | 能使溴水褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生聚合反应 |
| Y | Z | ||
| X | W |
| A. | X的氧化物是酸性氧化物,只能与碱反应 | |
| B. | X、Y、Z、W的最高价依次升高 | |
| C. | 化合物XW4、YZ中各原子均满足最外层8电子稳定结构 | |
| D. | Y的最简单气态氢化物和W的单质混合可产生白烟 |

 B.
B. C.
C. D.
D.

 .如果没有步骤③,D、F能反应吗?能.
.如果没有步骤③,D、F能反应吗?能. .
.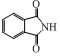 为原料,写出制备
为原料,写出制备 的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$
的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$ →
→ .
.

 按如图所示装置进行实验,以制取乙酸乙酯.
按如图所示装置进行实验,以制取乙酸乙酯.