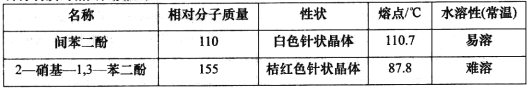
题目内容
【题目】下表列出了A~R 9种元素在周期表中的位置:

(1)F元素的名称为 ;画出B的原子结构示意图: 。
(2)这9种元素中,化学性质最不活泼的是_______;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是 。(填元素符号)
(3)A、D、E三种元素的最高价氧化物形成的晶体中属于分子晶体的是 ,A、B两元素的氧化物中熔点较高的是 ,C、D、F形成的氢化物分子中共价键的极性由强到弱的顺序为 。(填化学式)
(4)工业上用D的一种单质为原料生产E单质粗品的化学方程式为 。
(5)G和H的原子序数相差 。(填数字)
(6)写出一个能证明G比H活泼的化学方程式 。
【答案】(1)氧![]() ;
;
(2)Ar , B、Si ;
(3)CO2 ,MgO, H2O>CH4>BH3(或B2H6);
(4)2C+SiO2![]() 2CO↑+Si ;
2CO↑+Si ;
(5)18;
(6)Cl2+ 2KBr =" 2KCl" + Br2;
【解析】试题分析:(1)根据元素在周期表的位置可知F元素是第二周期第ⅥA的元素,元素的名称为氧;B是第三周期第IIA的Mg,其原子结构示意图是![]() ;(2)这9种元素中,化学性质最不活泼的是惰性气体元素Ar;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是处于金属与非金属交界区的元素B、Si;(3)A、D、E三种元素分别是K、C、Si,它们的最高价氧化物形成的晶体中属于分子晶体的是CO2,A、B两元素的氧化物分别是K2O、MgO,二者是离子晶体,熔化断裂离子键;离子键的强度MgO>K2O所以二者中熔点较高的是MgO;C、D、F分别是B、C、O,它们的非金属性O>C>B,元素的非金属性越强,其形成的共价键的极性就越强,所以三者形成的氢化物分子中共价键的极性由强到弱的顺序为H2O>CH4>BH3(或B2H6);(4)在工业上用C的一种单质为原料与SiO2在高温下发生反应生产E单质粗品,反应的化学方程式为2C+SiO2
;(2)这9种元素中,化学性质最不活泼的是惰性气体元素Ar;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是处于金属与非金属交界区的元素B、Si;(3)A、D、E三种元素分别是K、C、Si,它们的最高价氧化物形成的晶体中属于分子晶体的是CO2,A、B两元素的氧化物分别是K2O、MgO,二者是离子晶体,熔化断裂离子键;离子键的强度MgO>K2O所以二者中熔点较高的是MgO;C、D、F分别是B、C、O,它们的非金属性O>C>B,元素的非金属性越强,其形成的共价键的极性就越强,所以三者形成的氢化物分子中共价键的极性由强到弱的顺序为H2O>CH4>BH3(或B2H6);(4)在工业上用C的一种单质为原料与SiO2在高温下发生反应生产E单质粗品,反应的化学方程式为2C+SiO2![]() 2CO↑+Si;(5)G是Cl元素,原子序数是17,H是Br元素,原子序数是35,二者的原子序数相差35-17=18;(6)元素的非金属性越强,其单质的氧化性就越强,活动性强的可以把活动性弱的从化合物中置换出来,反应的方程式是:Cl2+ 2KBr =" 2KCl" + Br2。
2CO↑+Si;(5)G是Cl元素,原子序数是17,H是Br元素,原子序数是35,二者的原子序数相差35-17=18;(6)元素的非金属性越强,其单质的氧化性就越强,活动性强的可以把活动性弱的从化合物中置换出来,反应的方程式是:Cl2+ 2KBr =" 2KCl" + Br2。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案