��Ŀ����
��1��д����������ˮ��Һ�е���ĵ��뷽��ʽ
��2����˫���ŷ����������������ԭ��Ӧ�ĵ���ת�Ʒ���͵�������
2FeCl3+Fe=3FeCl2 �������� ���ѧʽ��
��3�����Ĵ������ǹ�ҵ��������Ļ�����4NH3 + 5 O2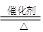 4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ�
4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ�
��4����һ�������£�RO3n-�������ɷ������·�Ӧ�� RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O�����Ϸ�Ӧ��֪���Ϲ�����RO3n-�� �����������ԭ������ RO3n-��Ԫ��R�Ļ��ϼ��� ��
��2����˫���ŷ����������������ԭ��Ӧ�ĵ���ת�Ʒ���͵�������
2FeCl3+Fe=3FeCl2 �������� ���ѧʽ��
��3�����Ĵ������ǹ�ҵ��������Ļ�����4NH3 + 5 O2
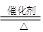 4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ�
4NO + 6H2O ��������Ϊ��ԭ���������� ���ѧʽ��������Ӧ��������0.2 mol NO����ת�� mol���ӣ���4����һ�������£�RO3n-�������ɷ������·�Ӧ�� RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O�����Ϸ�Ӧ��֪���Ϲ�����RO3n-�� �����������ԭ������ RO3n-��Ԫ��R�Ļ��ϼ��� ��
17.��1��Fe2(SO4)3=2Fe3+ +2SO42-��2�֣���2��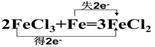 �� FeCl3
�� FeCl3
��3�� NH3�� 0.25 ��4�������� +4 ������ÿ��1��
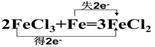 �� FeCl3
�� FeCl3 ��3�� NH3�� 0.25 ��4�������� +4 ������ÿ��1��
�����������2���Ȼ����е��������۽��͵����ۣ��ʵõ���һ�����ӣ�������ԭ��Ӧ��������������2���Ȼ����͵õ�2�����ӣ���������������ߵ����ۣ���ʧȥ��2�����ӣ�����������Ӧ������ԭ����
��3��NH3�е�N��-3�����ߵ�+2�ۣ�����������Ӧ������ԭ����O2�е�O��0�۽��͵�-2�ۣ�������ԭ��Ӧ������������
4NH4- 4NO- 5e��
0.2mol x x=0.25mol
��4���ɵ���غ��֪n=2����RO32-�е�R��+4�����ߵ�+6�ۣ�������������Ӧ��
���������⿼����������ԭ��Ӧ����������ԭ�����жϣ��ѶȲ���

��ϰ��ϵ�д�
 53������ϵ�д�
53������ϵ�д�
�����Ŀ
 CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O