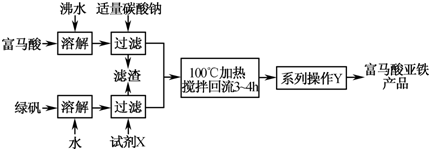
题目内容
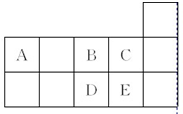 (2011?南京一模)如表为元素周期表短周期的一部分.下列有关A、B、c、D、E五种元素的叙述中,正确的是( )
(2011?南京一模)如表为元素周期表短周期的一部分.下列有关A、B、c、D、E五种元素的叙述中,正确的是( )分析:由元素在周期表中的位置可知:A为碳元素、B为氧元素、C为氟元素、D为硫元素、E为氯元素,
A.硫在氧气中燃烧生成二氧化硫;
B.氢氟酸是弱酸;
C.碳元素与氧元素可以组成CO32-、C2O42-;
D.氯气与消石灰反应生成氯化钙、次氯酸钙,可以制备漂白粉.
A.硫在氧气中燃烧生成二氧化硫;
B.氢氟酸是弱酸;
C.碳元素与氧元素可以组成CO32-、C2O42-;
D.氯气与消石灰反应生成氯化钙、次氯酸钙,可以制备漂白粉.
解答:解:由元素在周期表中的位置可知:A为碳元素、B为氧元素、C为氟元素、D为硫元素、E为氯元素,
A.硫在氧气中燃烧生成二氧化硫,二氧化硫在催化剂、加热条件下可以转化为三氧化硫,故A错误;
B.氢氟酸是弱酸,盐酸是强酸,盐酸的酸性更强,故B错误;
C.碳元素与氧元素可以组成CO32-、C2O42-,故C正确;
D.氯气与冷的消石灰反应生成氯化钙、次氯酸钙,可以制备漂白粉,故D正确;
故选CD.
A.硫在氧气中燃烧生成二氧化硫,二氧化硫在催化剂、加热条件下可以转化为三氧化硫,故A错误;
B.氢氟酸是弱酸,盐酸是强酸,盐酸的酸性更强,故B错误;
C.碳元素与氧元素可以组成CO32-、C2O42-,故C正确;
D.氯气与冷的消石灰反应生成氯化钙、次氯酸钙,可以制备漂白粉,故D正确;
故选CD.
点评:本题考查位置结构性质关系、元素化合物性质等,难度不大,注意整体把握元素周期表、全面掌握基础知识,C为易错点,容易忽略草酸根.

练习册系列答案
相关题目
 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( ) 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂