题目内容
10.我省的海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用资源和保护环境是我省可持续发展的重要保证.(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据如表数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-(任写一个).
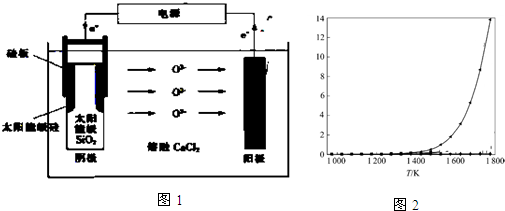
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图2所示.请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
分析 (1)由无水氯化镁制取金属镁的化学反应方程式 MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;
(3)①考察了强碱弱酸盐的水解反应的方程式的书写;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
解答 解:(1)由无水氯化镁制取金属镁的化学反应方程式 MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;所以用Na2S除去污水中的Cu2+和Pb2+效果更好,故答案为:Na2S;
(3)①天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),
故答案为:降低含硫烟气温度(或流速);
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-;中和、稀释经氧气氧化后海水中生成的酸(H+).
点评 本题考查了方程式的书写,氧化还原反应,沉淀溶解平衡,盐类水解等,掌握基础是关键,题目难度中等,综合性较强.

 名校课堂系列答案
名校课堂系列答案| A. | 加成反应 | B. | 氧化反应 | C. | 水解反应 | D. | 缩聚反应 |
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
| A. | 1mol•L-1NaHCO3溶液中的Na+数为NA | |
| B. | 常温时,4.4gCO2所含的氧原子数为0.2NA | |
| C. | 5.6g Fe与足量稀硝酸反应,转移电子数为0.2NA | |
| D. | 1molNa 与O2 反应生成Na2O2和Na2O电子转移数为0.1NA |
| A. | SO2通入过量的氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| B. | FeO溶于过量稀硝酸中:FeO+2H+═Fe2++H2O | |
| C. | NH4Al(SO4)2溶液中加入过量NaOH溶液中:NH4++Al3++4OH-═NH3•H2O+Al(OH)3↓ | |
| D. | 铜溶于酸化的H2O2溶液中:Cu+H2O2+2H+═Cu2++2H2O |
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡时的混合气体加压后颜色变深 |
| A. | 一种分散系中可以有一种分散质,也可以有多种分散质 | |
| B. | 胶体的分散质都能通过过滤从分散剂中分离出来 | |
| C. | 分散剂一定是液体 | |
| D. | 同一种溶质的饱和溶液要比不饱和溶液的浓度大 |
 甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程: