题目内容
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。
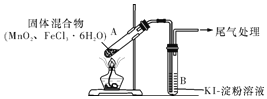
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
【答案】盐酸小液滴 FeCl3 2Fe3++2I-=2Fe2++I2 另取一支试管,向其中加入KI淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察溶液是否变蓝 A 排除Fe3+将Br-氧化成Br2的可能性 该实验条件下,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2 3MnO2+4FeCl36H2O![]() 2Fe2O3+3MnCl2+3Cl2↑+24H2O
2Fe2O3+3MnCl2+3Cl2↑+24H2O
【解析】
(1)FeCl3![]() 6H2O受热失去结晶水,同时水解,生成HCI气体,HCl和H2O结合形成盐酸小液滴;
6H2O受热失去结晶水,同时水解,生成HCI气体,HCl和H2O结合形成盐酸小液滴;
(2)FeCl3溶液中滴入KSCN溶液,发生络合反应,用KSCN溶液检验现象ii和A中的黄色气体,溶液均变红,说明含有FeCl3;
(3)①氯化铁具有强氧化性,可以将碘离子氧化为碘单质;
②作对照实验,需要除去Cl2和Fe3+的干扰才能检验酸性情况下的O2影响,所以最好另取溶液对酸性情况下氧气的影响进行检验。因为原题中存在HC1气体,所以酸化最好选用盐酸;
(4)①方案1:除去Cl2中的FeCl3和O2(H+),若仍能观察到B中溶液仍变为蓝色则证明原气体中确实存在Cl2,Cl2中的氯化氢的去除使用饱和NaCl溶液,饱和NaCl溶液也可以让FeCl3溶解,并且除去O2影响过程中提供酸性的HCI气体,从而排除两个其他影响因素;
②方案2:若B中观察到浅橙红色,则证明有物质能够将Br-氧化成Br2,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题;
③方案2:将B中KI-淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br 2;
(5)二氧化锰与FeCl3![]() 6H2O反应生成Fe2O3、MnCl2、Cl2及水,据此结合原子守恒书写反应方程式。
6H2O反应生成Fe2O3、MnCl2、Cl2及水,据此结合原子守恒书写反应方程式。
(1) FeCl36H2O受热失去结晶水FeCl36H2O![]() FeCl3+6H2O,同时水解FeCl3+3H2O
FeCl3+6H2O,同时水解FeCl3+3H2O![]() Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾,故答案为:HCl小液滴;
Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾,故答案为:HCl小液滴;
(2) FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-= Fe(SCN)3,生成血红色的硫氰化铁,用KSCN溶液检验现象ii和A中的黄色气体,溶液均变红,说明含有FeCl3,故答案为:FeCl3;
(1) ①碘离子具有还原性,氯化铁具有强氧化性,两者反应,碘离子被氧化为碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
②FeCl36H2O受热水解,生成HCl气体,作对照实验,需用盐酸酸化,另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝,若一段时间后溶液变蓝则推测成立,故答案为:另取一支试管,向其中加入KI淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察溶液是否变蓝,进行推测;
(4) ①方案1:氯化铁能氧化碘离子,氧气在酸性条件下,能氧化碘离子,所以需除去Cl2中的FeCl3和O2(H+),若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在Cl2,使用饱和NaCl溶液,可以让FeCl3溶解,并且除去O2影响过程中提供酸性的HCl气体,从而排除两个其他影响因素,故答案为:A;
![]() 方案2:若B中观察到浅橙红色,为溴水的颜色,则证明有物质能够将Br-氧化成Br2,铁离子不能氧化溴离子,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题,故答案为:排除Fe3+将Br-氧化成Br2的可能性;
方案2:若B中观察到浅橙红色,为溴水的颜色,则证明有物质能够将Br-氧化成Br2,铁离子不能氧化溴离子,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题,故答案为:排除Fe3+将Br-氧化成Br2的可能性;
![]() 选择NBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被
选择NBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被![]() 氧化为Br2,故答案为:该实验条件下,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2 ;
氧化为Br2,故答案为:该实验条件下,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2 ;
(5)二氧化锰与FeCl36H2O反应生成Fe2O3、MnCl2、Cl2及水,反应方程式为:3MnO2+4FeCl36H2O![]() 2Fe2O3+3MnCl2+3Cl2↑+24H2O,故答案为:3MnO2+4FeCl36H2O
2Fe2O3+3MnCl2+3Cl2↑+24H2O,故答案为:3MnO2+4FeCl36H2O![]() 2Fe2O3+3MnCl2+3Cl2↑+24H2O。
2Fe2O3+3MnCl2+3Cl2↑+24H2O。

【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。